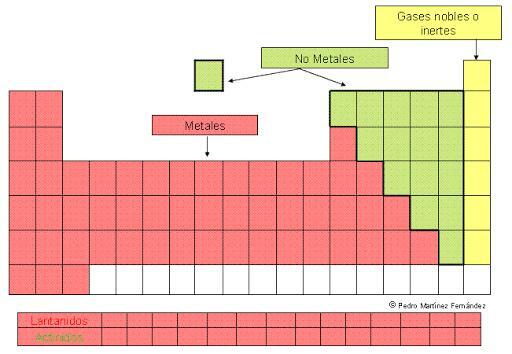
KLASIFIKÁCIA KOVOV v periodickej tabuľke

The kovy sú hojnejšie prvky na periodická tabuľka. Vyznačujú sa tým, že: sú dobrými vodičmi tepla a elektriny, sú pevné pri izbovej teplote (s s výnimkou ortuti, ktorá je tekutá) a majú schopnosť odrážať svetlo, takže pôsobia leskle charakteristický.
Ale táto veľká sada prvkov je prezentovaná usporiadaná v periodickej tabuľke v rôznych skupinách alebo rodinách, ktoré odrážajú ich podobnosti a rozdiely. V tejto lekcii od UČITEĽA uvidíme, čo klasifikácia kovov a aké sú vlastnosti a vlastnosti rôznych skupín definovaných v tejto klasifikácii.
Ako sme už uviedli, kovy sú väčšinou prvkov periodická tabuľka. Sú distribuované v dvaja skvelí chlapci ktoré zahŕňajú v každom prípade rôzne podtypy, ktoré sú zoskupené do skupín rôznych blokov periodickej tabuľky.
Ďalej uvádzame stručný prehľad tejto klasifikácie, ktorú podrobnejšie rozvinieme v nasledujúcich častiach.
- 1. Reprezentatívne kovy: s blok periodickej tabuľky.
- 1.1. Rodina alkalické kovy
- 1.2. Rodina kovy alkalických zemín
- 2. Prechodné kovy: blok d periodickej tabuľky.
- 3. Vnútorné prechodné kovy: blok f periodickej tabuľky.
- 3.1. Lanthanidy: prvky 6. obdobia tabuľky.
- 3.2. Aktinidy: prvky 7. obdobia tabuľky.
- 4. Post prechodné kovy: p blok periodickej tabuľky.
Obrázok: Educamix
Reprezentatívne prvky alebo hlavné prvky sú tie prvky, ktoré sú hojnejšie v prírode. Medzi kovovými prvkami sú reprezentatívne prvky kovy blok s, to znamená alkalické prvky (skupina 1 periodickej tabuľky) a prvky alkalických zemín (skupina 2 periodickej tabuľky).
V týchto dvoch skupinách nájdeme veľmi reaktívne prvky so silnou tendenciou oxidovať (strácať elektróny z valenčného obalu), a preto sú účinnými reduktormi ďalších prvkov. V prírode sa vyskytujú vo forme iónových solí veľmi dobre rozpustných vo vode, oxidoch alebo hydroxidoch (silné zásady).
Alkalické kovy (skupina 1 periodickej tabuľky)
- Alkalické kovy tvoria 5% zemskej kôry. Sodík (Na) a draslík (K) sú najhojnejšie.
- Oni sú lesklé prvky strieborný vzhľad, majú nízku hustotu, sú mäkké kovy a sú vysoko reaktívne. Vďaka svojej vysokej reaktivite sa v prírode nenachádzajú v čistom stave. Body varu alebo odparovania alkalických kovov sú pomerne nízke a sú dobrými vodičmi tepla a elektriny.
- Z hľadiska ich elektronickej konfigurácie sú to prvky, ktoré predstavujú a jeden elektrón zaberajúci s orbitál jeho valenčnej škrupiny. Majú kombinovanú silu 1 (valencia) a oxidačné číslo +1. Vykazujú veľkú tendenciu strácať elektrón z najvzdialenejšieho obalu za vzniku katiónov.
- Ako bioelementy sa alkalické kovy vyvíjajú a dôležitú úlohu v živých organizmoch, najmä sodík a draslík, ktoré hrajú zásadnú úlohu pri nervovom prenose a v prípade draslíka pri regulácii aktivity enzýmov.
- Tieto kovy majú viacnásobné použitie v priemysle. Napríklad lítium (Li) sa používa na výrobu vysoko pevných hliníkových zliatin, pri výrobe keramiky alebo ako súčasti batérií. Má tiež medicínske použitie, pretože tvorí súčasť nervového systému a jeho nedostatok spôsobuje psychiatrické ochorenia.
Poznámka: Do skupiny 1 periodickej tabuľky patrí aj vodík, ktorý nie je kovom.
Kovy alkalických zemín (skupina 2 periodickej tabuľky):
- Kovy alkalických zemín predstavujú 4% zloženia zemskej kôry. Sú obzvlášť bohaté vápnik (Ca) a horčík (Mg).
- Rovnako ako alkalické kovy, aj tieto kovy sú veľmi reaktívne takže sa v prírode nenachádzajú vo voľnej forme.
- Aj keď majú podobné fyzikálno-chemické vlastnosti ako alkalické kovy, bývajú tvrdšie a menej reaktívne ako alkalické kovy. Majú nízku hustotu a tvrdosti a teploty topenia vyššie ako u alkalických kovov.
- Z hľadiska konfigurácie elektrónov sa vyznačujú predstavte vyplnený s orbitál valenčnej škrupiny (to je obsadené dvojicou elektrónov). Preto majú kombinujúcu silu 2 (valencia) a oxidačné číslo +2. Ľahko reagujú s halogénmi (skupina 17 periodickej tabuľky) za vzniku iónových solí.
- Vaša rola ako zložky živých organizmov je obzvlášť dôležitý v prípade vápnika (Ca) a horčíka (Mg). Ióny horčíka a vápnika sú spolu s chloridovým iónom (Cl. I.) Najpočetnejším iónom morskej vody-).
- 99% vápnika v našom tele sa nachádza v kostre, ale v jeho iónovej forme má zásadnú úlohu v nervovom prenose, nervovosvalovej funkcii a regulácii enzymatický.
- Horčík vo svojej iónovej forme plní dôležité biologické funkcie v živých organizmoch vrátane Najvýznamnejšia je jej základná úloha vo fotosyntéze rastlín ako zložky chlorofyl.
- Priemyselné využitie kovov alkalických zemín je rôzne. Najdôležitejšie sú použitie vápnika ako zložky cementu, použitie horčíka na hasenie požiaru umelý, ako náter železných štruktúr na zabránenie oxidácie alebo ako súčasť zliatin a ocelí svetlo.
Obrázok: Webové stránky Google
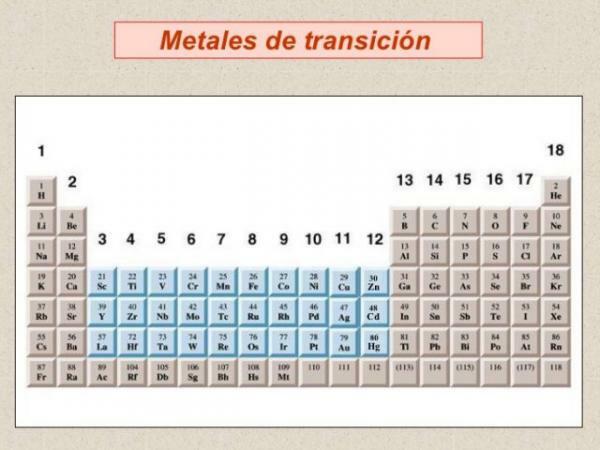
V rámci klasifikácie kovov musíme hovoriť o prechodných kovoch alebo kovoch blok d, sú najpočetnejšou skupinou kovov a sú zoskupené do a spolu 10 skupín alebo rodín periodickej tabuľky.
- Väčšina prechodných kovov má podobné vlastnosti ako reprezentatívne kovy: sú dobré vodiče tepla a elektriny a odrážajú svetlo.
- Vykazujú veľkú variabilitu, pokiaľ ide o tvrdosť a teploty varu a teploty topenia, ale vo všeobecnosti sú tvrdšie a majú vyššie teploty topenia a varu ako alkalické kovy a alkalické zeminy.
- Z chemické hľadisko sú charakterizované tým, že: majú viac koordinačných čísel (valencie) alebo oxidačných stavov, sú zvyčajne dobrými katalyzátormi (schopnosť zvýšiť alebo znížiť rýchlosť chemických reakcií) a vytvárať zlúčeniny s farbou a majú schopnosť tvoria koordinačné komplexy (chemické zlúčeniny s kovovým iónom v strede, pripojené k rade ligandov usporiadaných na ich okolo). Z tohto dôvodu prechodné kovy tvoria katióny rôznych nábojov.
- Hustota je veľmi premenlivá v tomto bloku prvkov, od stroncia s nízkou hustotou po osmium (Os), čo je prvok s najvyššou hustotou v periodickej tabuľke.
- Ak sa pozrieme na elektronickú konfiguráciu prechodných kovov, sú charakterizované prezentáciou čiastočne vyplnené d orbitaly. Vyplnenie orbitálov v tomto bloku periodickej tabuľky predstavuje sériu nezrovnalostí, ktoré sa odrážajú vo viacerých oxidačných číslach získaných kovmi v tomto bloku tabuľky periodicky.
Železo (Fe) a titán (Ti): hojnejšie prechodné kovy
- Železo je najhojnejšie a predstavuje asi 5% hmotnosti zemskej kôry. Je zriedkavé nájsť ho v elementárnej forme v prírode, kde sa bežne vyskytuje ako oxidy a uhličitany.
- Čisté železo má málo využití, ale jeho zliatiny s inými látkami majú viacnásobné použitie. Užitočnou formou zliatin železa je tepané železo (jedná sa o zliatinu železa, ktorá sa vyznačuje nízkym obsahom uhlíka a vysokým obsahom železa. Má tú vlastnosť, že môže byť žhavo tvarovaná a pri rýchlom ochladení tvrdne), liatinu (ktorá je tiež známa ako pod menom šedá liatina alebo liatina, ide o zliatinu železa, kremíka a uhlíka, ktorá obsahuje malé množstvo mangánu, fosforu a síra; v ktorom je uhlík vo forme grafitu) a ocele (čistená zliatina železa a uhlíka).
- Ostatné prechodové kovy široko používané v priemysle sú meď a striebro. Okrem toho sa veľa prechodných kovov používa v priemysle ako katalyzátor chemických reakcií.
- Na biologickej úrovni má železo v iónovej forme zásadnú úlohu v transport kyslíka, pretože je súčasťou aktívneho centra hemoglobínu a myoglobínu.
Obrázok: stránka 100cia
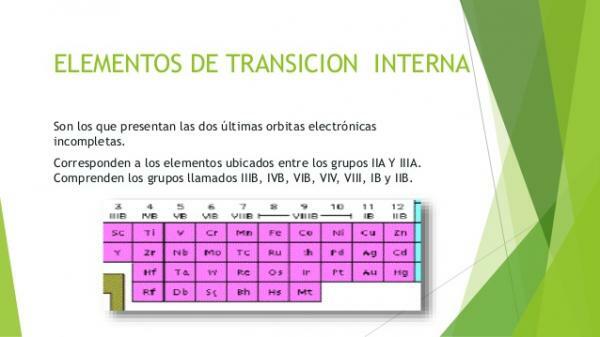
Vnútorné prechodné kovy alebo kovy z blok fHovorí sa im aj vzácne zeminy. Sú zoskupené do dvoch skupín prvkov: lantanoidy a aktinidy. Sú to tie kovové prvky, v ktorých sa nachádzajú elektróny obsadzujúce f orbitály. Prvky skupiny lantanoidov čiastočne obsadili orbitaly úrovne 4 a aktinidy úrovne 5.
Lantanoidy alebo lantanoidy
- Je to 15 prvkov vnútorného prechodu ktoré sú súčasťou obdobie 6 periodickej tabuľky prvkov.
- Táto skupina prvkov má spoločné charakteristické vlastnosti. Je o mäkké a striebro žiariace kovy, Jeho vodivosť tepla a elektriny je v porovnaní s inými kovmi relatívne nízka. Sú to kovy s nižšou hustotou ako prechodné kovy.
- V prírode sa vyskytujú v nízkych pomeroch, sú súčasťou mnohých minerály. Lantanidy majú vysokú kapacitu na magnetizáciu alebo magnetizáciu a vyznačujú sa tiež luminiscenciou svojich katiónov.
- Lanthanoidy majú viacnásobné použitie v priemysle pri výrobe silných permanentných magnetov, nabíjateľných batérií a výrobe supravodivých materiálov. Majú mnohostranné použitie v optike (výroba žiariviek a lámp, displejov a laserov z tekutých kryštálov). Používajú sa tiež ako katalyzátory chemických reakcií alebo ako pigmenty.
Aktinidy alebo aktinoidy
- Je to 15 prvkov ktoré tvoria obdobie 7 periodickej tabuľky.
- Mnohé z nich boli umelo syntetizované, ale nachádzajú sa aj v prírode vo veľmi malom množstve.
- Vykazujú podobné správanie ako prechodné kovy (blok d) a odlišné od správania lantanoidov. Rovnako ako v prípade mnohých kovov, majú charakteristický striebristý lesk.
- Ako skupina spočíva ich dôležitosť v tom, že sú všetci rádioaktívne prvky. To znamená, že ide o prvky, ktorých jadrá sú nestabilné, rozpadajú sa, uvoľňujú energiu (jadrová energia) a vedú k vzniku ďalších chemických prvkov so stabilnejším jadrom. Všetky izotopy prvkov v tejto skupine sú rádioaktívne a majú krátky polčas. Najhojnejším aktinidom v prírode je urán (U) a tórium (Th).
Obrázok: Prezentácia

