DEFINÍCIA kladných alebo záporných IÓNOV

Ako už vieme, atómy sú tvorené subatomárne častice. Z troch typov subatomárnych častíc iba neutróny nemajú elektrický náboj. Namiesto toho majú protóny pozitívny elektrický náboj, zatiaľ čo elektróny majú negatívny náboj. Iba elektróny, ktoré zaberajú perifériu atómu, je možné prenášať z jedného atómu na druhý, zatiaľ čo protóny v jadre si zachovávajú stabilný počet. V tejto lekcii UČITEĽA uvidíme, čo sa stane, keď atómy alebo molekuly získajú alebo stratia elektróny. To znamená, že uvidíme definícia a príklady pozitívnych alebo negatívnych iónov.
Register
- Čo sú ióny? Ľahká definícia
- Tvorba iónov: elektroafinita a elektronegativita
- Čo sú negatívne ióny? S príkladmi
- Čo sú pozitívne ióny? S príkladmi
Čo sú ióny? Ľahká definícia.
A ión je akýkoľvek atóm alebo molekula so sieťovým elektrickým nábojom. To znamená, že ide o atóm alebo skupinu atómov spojených dohromady, ktorých elektrické náboje sú nie sú kompenzované. Táto dekompenzácia nábojov nastáva, keď sa jeden alebo viac elektrónov spojí alebo opustí atóm alebo skupinu atómov.
Ióny sú teda nabité atómy alebo molekuly, v dôsledku zisku alebo straty elektrónov (subatomárne častice so záporným nábojom a zanedbateľnou hmotnosťou).
Typy iónov: monatomické a polyatomické
Ak vezmeme do úvahy zloženie iónov, rozlišujú sa dva typy: monatomické ióny a polyatomické ióny.
- Ako už názov napovedá, monatomické ióny tie, ktoré sú tvorené a jediný atóm.
- Iónové zlúčeniny o polyatomické ióny sú tie, v ktorých sú atómy kovalentne viazané (zdieľajú jeden alebo viac párov elektrónov vo väzbe) a predstavujú množstvo neutróny v molekule odlišné od celkového počtu elektrónov.
- The polyatomické ióny obyčajne obsahujú kyslík a zvyčajne majú štruktúru s centrálnym atómom, okolo ktorej sú usporiadané zvyšné prvky, ktoré tvoria molekulu.
- The náboj jednoatómových iónov reprezentatívnych prvkov (rodiny 1 a 2 tabuľky a rodiny 13 až 17 periodickej tabuľky) možno ľahko odvodiť, ak je známe ich umiestnenie v periodickej tabuľke. V týchto prípadoch atómy získavajú alebo strácajú elektróny, aby vo svojej valenčnej škrupine dosiahli konfiguráciu vzácneho plynu svojej doby (s2p6), alebo čo je rovnaké, splniť oktetové pravidlo.
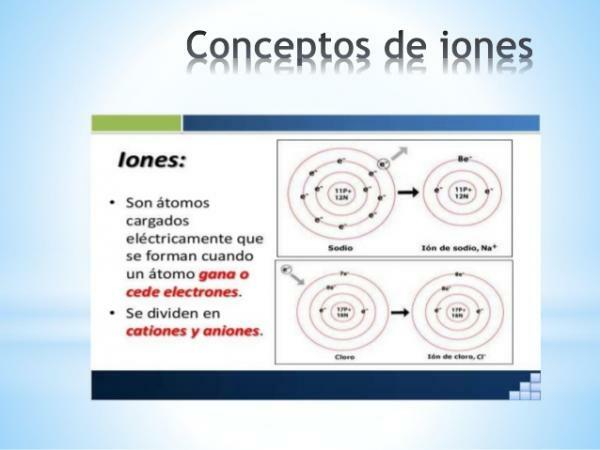
Obrázok: Prezentácia
Tvorba iónov: elektroafinita a elektronegativita.
Schopnosť atómov alebo molekúl dosiahnuť tvoria ióny je určené dvoma periodickými vlastnosťami: elektroafinita a elektronegativita. Obidve vlastnosti v priebehu obdobia zvyšujú hodnotu a znižujú sa, keď zostupujeme cez skupinu alebo rodinu periodickej tabuľky.
The elektroafinita, tiež nazývaná elektrónová afinita, je atómová vlastnosť, ktorá je definovaná ako schopnosť atómu priťahovať elektróny. V prípade zlúčenín podobná vlastnosť tzv elektronegativita ktorá je definovaná ako schopnosť atómu priťahovať elektróny, keď vytvára väzbu s iným atómom. Obe vlastnosti teda definujú tendenciu prvku zachytávať alebo strácať elektróny.
Iónové väzby
Ióny v pevnej forme tvoria zlúčeniny alebo iónové kryštály (soli), ktoré sú tvorené kombináciou iónov rôznych znakov spojených dohromady pomocou iónové väzby. Najznámejším príkladom tohto typu zlúčeniny je kuchynská soľ (chlorid sodný: NaCl).
Iónová väzba sa skladá z zväzkov iónov rôzneho znamienka pomocou elektrostatických príťažlivých síl (príťažlivosť medzi nábojmi opačného znamienka). Prvky, ktorých elektronegativita alebo elektroafinita sú veľmi odlišné (kovové a nekovové prvky), zasahujú do tohto typu väzieb. Vo väčšine prípadov sú to tieto iónové zlúčeniny rozpustný vo vode a ďalšie polárne rozpúšťadlá.
Vo vodných roztokoch sa iónové zlúčeniny disociujú na voľné ióny, ktoré tzv elektrolyty, pretože jeho prítomnosť v roztoku spôsobuje, že sa voda správa ako elektrický vodič.
Čo sú negatívne ióny? S príkladmi.
The negatívne ióny Volajú sa anióny. Vo všetkých prípadoch ide o atómy nekovových prvkov alebo molekuly, ktoré obsahujú nekovové prvky. Tieto prvky sa vyznačujú veľmi vysokou elektroafinitou a elektronegativitou. To znamená, že sú to ióny tvorené prvkami s vysoká tendencia zachytávať elektróny.
Monatomické anióny: definícia a príklady
Sú to anióny tvorené atómami nekovových prvkov (skupiny 13 až 17 periodickej tabuľky), ktoré získali jeden alebo viac elektrónov. Tieto anióny majú spoločnú elektronickú štruktúru vzácneho plynu (s. 2)2p6) vo svojom najvzdialenejšom elektrónovom obale (valenčný obal).
Príklady:
- Chloridový ión: Cl-
- Fluoridový ión: F-
- Jodidový ión: I-
- Sulfidový ión: S-2
- Nitridový ión: N-3
Polyatómové anióny: definícia a príklady
Sú to negatívne nabité ióny tvorené dvoma alebo viacerými atómami nekovových prvkov spojených kovalentnými väzbami. Sú to najbežnejšie polyatómové ióny. Najbežnejšie polyatómové anióny sú oxoanióny, ktoré sú tvorené nekovovým centrálnym atómom a obsahujú kyslík.
Všeobecne sa považujú za chemické zlúčeniny získané, keď kyslá zlúčenina stratí jeden alebo viac protónov (H+). Tieto polyatómové anióny môžu vo svojej štruktúre zadržiavať časť vodíka, čo im dáva určitý kyslý charakter (schopnosť vzdať sa protónov).
Príklady:
- Dusičnanový ión: NO3-
- Permanganátový ión: MnO4-
- Fosfátový ión: PO4-3
- Ión hydrogénuhličitanu alebo hydrogenuhličitanu: HCO3-
- Siričitanový ión: SO3-2
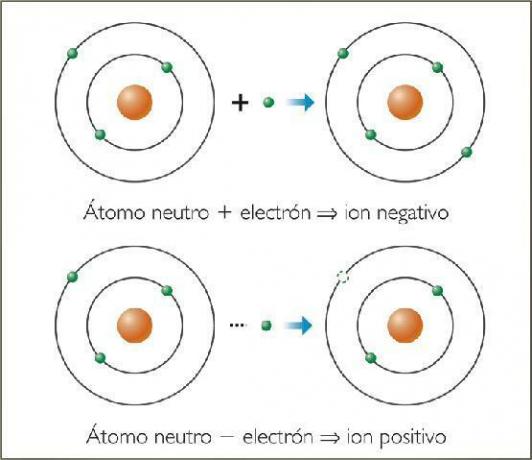
Obrázok: Naturopatia
Čo sú pozitívne ióny? S príkladmi.
Pozitívne ióny sa nazývajú cacie. Takmer vo všetkých prípadoch ide o atómy kovových prvkov alebo molekuly, ktoré obsahujú kovové prvky. Tieto prvky sa vyznačujú veľmi nízkou elektroafinitou a elektronegativitou, a preto majú zjavnú tendenciu strácať elektróny.
Monatomické katióny: definícia a príklady
Sú to ióny s kladným nábojom (v dôsledku straty elektrónov) tvorené jedným atómom kovového prvku. V tomto prípade je katión tvorený stratou elektrónov, ktoré umožňujú prvku vyprázdniť vonkajšiu elektronickú vrstvu a získať konfiguráciu vzácneho plynu (s2p6) z nižšej úrovne. Sú najbežnejším typom katiónov.
Príklady:
- Vodíkový alebo hydrónový katión (tiež nazývaný protón): H+
- Sodný katión: Na+
- Katión železa (III) alebo katión železitý: Fe+3
- Vápnikový katión: Ca+2
- Meď (II) alebo meďnatý katión: Cu+2
Polyatómové katióny: definícia a príklady
Polyatómové katióny sú katióny tvorené dvoma alebo viacerými atómami. Sú zriedkavé, najhojnejšie sú takzvané homopolyatomické katióny, ktoré obsahujú viac ako jeden katión. atóm rovnakého prvku, v prípade trihydrogénneho iónu je to jedna z najpočetnejších molekúl v vesmír. Polyatómové katióny tvorené atómami rôznych prvkov nie sú bežné, ale vyznačujú sa tým prítomnosť vodíka a predpokladá sa, že vzniká, keď bázická zlúčenina zachytí protón (H+).
Príklady:
- Amónny katión: NH4+
- Oxóniový katión: HO3+
- Fosfóniový katión: PH3+
- Trihydrogénový katión alebo protónovaný molekulárny vodík: H3+
- Katión dimtuti: Hg2+2
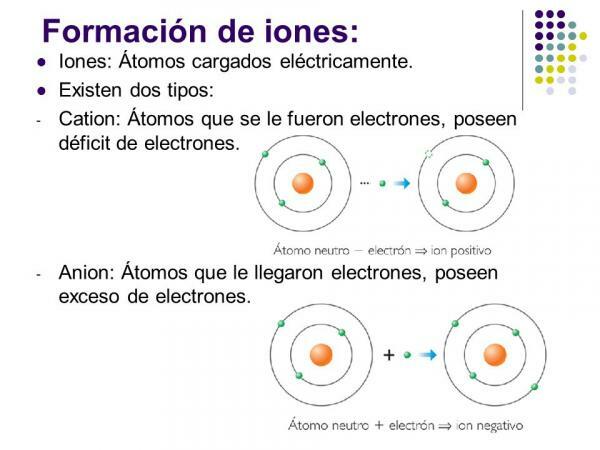
Obrázok: Planéty
Ak si chcete prečítať viac podobných článkov Negatívne a pozitívne ióny: definícia a príklady, odporúčame vám vstúpiť do našej kategórie Atóm.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Základná chémia. Madrid: Uned
