Rozdiel medzi silnými a slabými kyselinami a zásadami (s príkladmi)
Klasifikácia kyselín a zásad v chémii závisí od ionizačnej sily týchto látok vo vodnom prostredí. A) Áno:
- a kyselina a báza sú silné keď sú úplne ionizované, to znamená, že sa v procese ionizácie úplne transformujú na katióny alebo pozitívne ióny a na anióny alebo negatívne ióny.
- Na druhej strane, kyselina a báza sú slabé keď sú čiastočne ionizované vo vode, to znamená, že v roztoku bude podiel katiónov, ďalší podiel aniónov a ďalší podiel nedisociovaných molekúl.
| Silné kyseliny a zásady | Slabé kyseliny a zásady | |
|---|---|---|
| Definícia | Látky, ktoré sa v roztoku úplne ionizujú. | Látky, ktoré sa v roztoku čiastočne ionizujú. |
| Ionizácia | Dokončené | Čiastočné |
| Prvky vo vodnom roztoku | Katióny a anióny v rovnakej koncentrácii. | Katióny, anióny a molekuly v rôznych pomeroch. |
| Ionizačná konštanta | Vyvýšené | Malý |
| Príklady |
|
|
Silné kyseliny a zásady
A kyselina alebo zásada sú silné, ak sú vo vodnom prostredí úplne disociovanéInými slovami, ionizačný proces je dokončený a roztok bude obsahovať rovnakú koncentráciu aniónov a katiónov.
Ako ionizujete kyselinu a silnú bázu?
Silná kyselina, napríklad kyselina chlorovodíková, sa ionizuje nasledujúcimi spôsobmi:
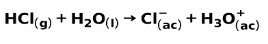
Silná zásada, ako je hydroxid sodný NaOH, ionizuje nasledujúcimi spôsobmi:
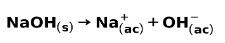
Príklady silných kyselín a ich vzorce
| Silné kyseliny | Vzorec |
|---|---|
| Kyselina chlorovodíková | HCl |
| Kyselina sírová | H2SW4 |
| Kyselina dusičná | HNO3 |
| Kyselina bromovodíková | HBr |
| Kyselina chloristá | HClO4 |
| Kyselina chrómová | H2CrO4 |
| Kyselina tetrafluroboritá | HBF4 |
Príklady silných zásad a ich vzorcov
| Silný základ | Vzorec |
|---|---|
| Hydroxid sodný | NaOH |
| Hydroxid lítny | LiOH |
| Hydroxid draselný | KOH |
| Hydroxid rubídny | RbOH |
| Hydroxid cézny | CsOH |
| Hydroxid vápenatý | Ca (OH)2 |
| Hydroxid bárnatý | Ba (OH)2 |
| Hydroxid strontnatý | Sr (OH)2 |
| Hydroxid hlinitý | Al (OH)3 |
Možno by vás zaujímalo viac príklady kyselín a zásad.
Slabé kyseliny a zásady
A Kyselina alebo zásada sú slabé, ak sú čiastočne ionizované vo vodnom roztoku, to znamená, že v roztoku sú ióny a neionizované molekuly.
Ako ionizujete kyselinu a slabú bázu?
Slabá kyselina, napríklad kyselina octová CH3COOH, je ionizovaný nasledujúcim spôsobom:
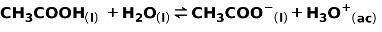
Rovnováha tejto reakcie je vyjadrená dvoma šípkami v opačných smeroch.
Keď sa slabá kyselina disociuje alebo ionizuje, nastane rovnováha medzi druhmi prítomnými v roztoku; to môže byť vyjadrené a ionizačná konštantakyslé:
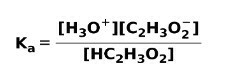
Ionizačná konštanta nie je nič iné ako pomer medzi násobením koncentrácie produktov a násobením koncentrácie reaktantov.
Slabá zásada, ako je NH amoniak3, je ionizovaný nasledujúcim spôsobom:
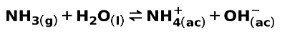
Keď sa slabá báza disociuje alebo ionizuje, nastáva rovnováha medzi druhmi prítomnými v roztoku; to môže byť vyjadrené a základná ionizačná konštanta:
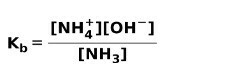
Môže vás zaujímať rozdiel medzi Kyseliny a zásady.
Príklady slabých kyselín s ich vzorcom a kyslou ionizačnou konštantou Kdo
| Slabá kyselina | Vzorec | Ionizačná konštanta |
|---|---|---|
| Kyselina mravčia | H2CO2 | 1,77 x 10-4 |
| Octová kyselina | H3CCOH | 1,75 x 10-5 |
| Kyselina kyanovodíková | HOCN | 3,30 x 10-4 |
| Kyanovodík | HCN | 6,20 x 10-10 |
| Kyselina chlórna | HOCl | 3,50 x 10-8 |
| Kyselina dusitá | HNO2 | 4,00 x 10-4 |
| Kyselina mliečna | HC3H5ALEBO3 | 1,40 x 10-4 |
| Kyselina uhličitá | H2CO3 |
4,30 x 10-7 5,60 x 10-11 |
| Kyselina boritá | H3BO3 |
5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Príklady slabých báz s ich vzorcom a základnou ionizačnou konštantou Kb
| Slabý základ | Vzorec | Ionizačná konštanta |
|---|---|---|
| Amoniak | NH3 | 1,75 x 10-5 |
| Metylamín | CH3NH2 | 4,38 x 10-4 |
| Etylamín | C.2H5NH2 | 5,60 x 10-4 |
| Anilín | C.6H5NH2 | 3,80 x 10-10 |
| Pyridín | C.5H5N | 1,70 x 10-9 |
| Benzylamín | C.7H9N | 2,20 x 10-5 |
| Hydrogenuhličitan sodný | NaHCO | 2,00 x 10-4 |
Možno by vás zaujímalo viac informácií o Charakteristika kyselín a zásad