Charakteristika kyselín a zásad: hlavné rozdiely
Charakteristickými vlastnosťami kyselín a zásad sú všetky tie vlastnosti a vlastnosti, pomocou ktorých môžeme rozlišovať medzi kyselinou a zásadou.
Podľa Arrehniusovej teórie, a kyselina je látka, ktorá uvoľňuje protóny H+ keď sa rozpustí vo vode, a a základňa je akákoľvek látka, ktorá uvoľňuje hydroxylové ióny OH- keď je vo vodnom roztoku.
| Kyseliny | Bázy | |
|---|---|---|
| Tvorba iónov | Prítomný | Prítomný |
| Neutralizačná reakcia | Keď reaguje s bázou. | Keď reaguje s kyselinou. |
| Rozpustnosť vo vode | Rozpustný | Čiastočne rozpustný. Hydroxidy vápnika, bária a hliníka sú zle rozpustné. |
| Elektrická vodivosť | Prítomný | Prítomný |
| Stav hmoty | Tuhé, kvapalné alebo plynné | Tuhé, kvapalné alebo plynné |
| Reakcia s lakmusovým papierikom | Červené sfarbenie | Modré sfarbenie |
| Hodnota PH | Menej ako 7 rokov | Viac ako 7 |
| Konjugovaný náprotivok | Slabá kyselina vytvára konjugovaný základ. | Slabá zásada vytvára konjugovanú kyselinu. |
| Žieravý účinok | Silné kyseliny | Silné základy |
Charakteristika kyselín
Kyseliny majú niekoľko charakteristík, pomocou ktorých je možné ich identifikovať.
Schopnosť vytvárať ióny z kyselín
Hlavnou charakteristikou kyslých látok je, že môžu byť ionizované, to znamená stratiť alebo získať elektróny.
Kyselina chlorovodíková HCl, silná kyselina, ionizuje za vzniku chloridového aniónu Cl- a protón H+.
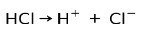
Neutralizačná reakcia
Kyselina reaguje s bázou za vzniku soli a vody. Táto reakcia je známa ako neutralizačná reakcia. Napríklad HCl reaguje s NaOH za vzniku chloridu sodného NaCl (kuchynská soľ) a vody:
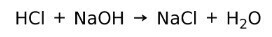
Rozpustnosť kyselín vo vode
Kyseliny sú všeobecne rozpustné vo vode. Napríklad kyselina chlorovodíková alebo kyselina muriatová sú mierne rozpustné vo vode, až 82 g HCl sa môže rozpustiť v 100 ml vody pri 0 ° C. V prípade kyseliny sírovej H2SW4, zmiešaním s vodou sa vytvára teplo, preto je vždy vhodné pridať do vody kyselinu, aby nedošlo k výbuchu.
Kyselinová sila
Ako sú kyseliny disociujúce, závisí od toho, či sú silné alebo slabé. Sila kyseliny je daná jej disociačná konštanta.
Kyselina dusičná HNO3 je to silná kyselina pretože vo vodnom roztoku sa úplne ionizuje na protóny a dusičnanové ióny:

To znamená, že keď pridáme HNO3 vo vode, pri analýze vody nájdeme iba H+ a dusičnanové ióny a prakticky žiadny HNO3.
Namiesto toho je v octe kyselina octová a slabá kyselina, pretože iba jeho časť je disociovaná:
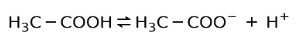
Preto je znázornený šípkami v dvoch smeroch, to znamená, že vo vodnom roztoku budeme mať kyselinu octovú, H+ a octanový anión (H3C-COO-).
Skupenstvo látok kyselín
Kyseliny možno nájsť v tekutom, pevnom alebo plynnom skupenstve. Napríklad kyselina chlorovodíková HCl je kvapalná, sírovodík HS je plyn a kyselina šťaveľová je pevná látka.
Reakcia s lakmusovým papierikom z kyselín

Keď vložíme pás lakmusového papiera do kyslej látky, lakmusový papierik zčervená.
Identifikácia kyselín podľa ich pH
PH je mierou množstva H+ prítomný v riešení. Teda medzi pH 0 a 7 sme v prítomnosti kyseliny. Napríklad ocot má pH rovné 2, pH kyseliny sírovej v autobatériách je rovné 1.
Elektrická vodivosť kyselín
Pretože kyseliny môžu disociovať a produkovať elektricky nabité ióny, kyslé roztoky môžu viesť elektrinu. Napríklad vo vnútri autobatérií sa ako vodič elektriny používa kyselina sírová, ktorá je silnou kyselinou.
Žieravý účinok silných kyselín
Silné kyseliny pôsobia korozívne, môžu spaľovať organické tkanivá, takže pri manipulácii s nimi musí byť mimoriadna opatrnosť.
Slabé kyseliny tvoria konjugovaný náprotivok
Slabé kyseliny po rozpustení tvoria takzvaný konjugovaný pár, to znamená, že slabá kyselina vytvára konjugovaný základ.
Napríklad:

V takom prípade tvorí kyselina mravčia alebo metánová (HCOOH), ak je disociovaná, formát konjugovaného bázického iónu.
Môže vás zaujímať:
- Silné a slabé kyseliny a zásady.
- Príklady kyselín a zásad.
Charakteristika základov
Ďalej uvádzame vlastnosti zásad alebo alkalických roztokov, ktoré ich charakterizujú.
Základná ionizačná kapacita
Základné alebo alkalické látky sa vyznačujú tvorbou iónov po rozpustení vo vode:

V tomto prípade sa hydroxid sodný NaOH ionizuje za vzniku hydroxidového aniónu OH- a katión sodný Na+.
Báza reaguje s kyselinou za vzniku soli
Báza reaguje s kyselinou v neutralizačnej reakcii za vzniku vody a soli, napríklad:

V tomto prípade hydroxid hlinitý Al (OH)3, zásada, reaguje s HCl a vytvára chlorid hlinitý soľ AlCl3 a voda. Hydroxid hlinitý sa používa ako antacido na zmiernenie žalúdočného refluxu neutralizáciou kyseliny produkovanej žalúdkom.
Rozpustnosť vo vode
Niektoré zásady sú rozpustné vo vode. Hydroxidy alkalických zemín, ako je hydroxid vápenatý a hydroxid bárnatý, sú zle rozpustné vo vode. Napríklad hydroxid sodný alebo lúh sodný možno rozpustiť 109 g v 100 ml vody pri 20 ° C. Zatiaľ čo hydroxid horečnatý alebo magnéziové mlieko Mg (OH)2 je prakticky nerozpustný vo vode.
Pevnosť základne
Podľa stupňa ionizácie bázy môžu byť silné alebo slabé. Napríklad hydroxid lítny je a silná základňa pretože vo vodnom roztoku úplne ionizuje na hydroxidové ióny OH a lítium Li katióny+:
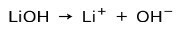
Na druhej strane amoniak NH3 je a slabá báza pretože pri kontakte s vodou sa neoddeľuje všetok amoniak:
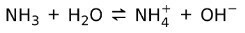
Stav základov
Zásady možno nájsť v tuhom, kvapalnom a plynnom skupenstve. Napríklad čistý hydroxid sodný je tuhý, amoniak je plyn.
Reakcia s lakmusovým papierikom báz
Keď vložíme pás lakmusového papiera do alkalickej látky, papier sa zafarbí na modro.
Identifikácia zásad podľa ich pH
Bázy sa vyznačujú tým, že majú pH medzi 7 a 14.
 Elektrická vodivosť báz
Elektrická vodivosť báz
Bázy sú vďaka svojej ionizačnej schopnosti dobrými vodičmi elektriny. Napríklad v alkalických batériách sa ako elektrický vodič používa hydroxid draselný KOH.
Korozívny účinok zásad
Silné bázy môžu poškodiť organické tkanivá. Napríklad čističe kuchynských rúrok sú zvyčajne silným základom a vždy sa s nimi odporúča zaobchádzať mimoriadne opatrne, nosiť rukavice a chrániť oči.
Slabé zásady tvoria konjugovaný náprotivok
Slabé zásady po rozpustení tvoria konjugovaný náprotivok, to znamená, že slabá báza tvorí konjugovanú kyselinu.
Napríklad tris- (hydroxymetyl) aminometán (OHCH2)3CNH2 je slabá zásada, ktorej konjugovanou kyselinou je (OHCH2)3CNH3+:
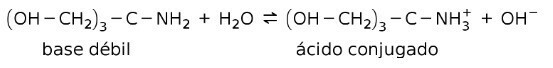
To je základ pôsobenia tlmivých látok resp nárazník, čo sú látky, ktoré sa používajú na neustále udržiavanie pH roztokov.
Mohlo by vás zaujímať, aké sú rozdiely medzi:
- Kyseliny a zásady.
- Katióny a anióny



