10 typov chemických prvkov (vysvetlených a klasifikovaných)
Koľko chemických prvkov musí existovať vo vesmíre? K tejto otázke je ešte dlhá cesta, pretože vedci si z času na čas vytvoria vlastné umelé chemické prvky.
Na čo však môžeme odpovedať, je koľko typov chemických prvkov musí existovať, niečo, čo sa dozvieme nabudúce.
- Súvisiaci článok: „11 typov chemických reakcií“
Druhy chemických prvkov
V prírode nájdeme všetky druhy látok. Tieto látky sa zvyčajne nenachádzajú v čistom stave, ale sú výsledkom kombinácie rôznych prvkov alebo materiálov, ktoré v dôsledku rôznych reakcií, procesov a časových období viedli k vzniku všetkých druhov záležitosť. Vo vesmíre neexistuje nič, čo by nebolo výsledkom kombinácie atómov patriacich k rôznym druhom chemických prvkov, ktoré uvidíme do hĺbky.
Predtým, ako sa pozrieme na typy chemických prvkov, urobme si však malý prehľad stredoškolskej vedy a zapamätajme si, čo sú chemické prvky.
Nazývame hmotu „chemického prvku“, ktorá je zložená z rovnakého typu atómu, tj. Z látky, ktorá je atómovo čistá. Chemické prvky nie je možné rozložiť na jednoduchšie a sú zaradené do periodickej tabuľky
prvkov ako čistých materiálov vesmíru.Ale pozor! Nesmieme si zamieňať prvky s jednoduchými látkami, pretože v určitých prípadoch môžu tvoriť dva alebo viac atómov toho istého prvku molekuly zoskupené rôznymi spôsobmi, ktoré spôsobujú zmenu niektorých fyzikálnych vlastností predmetného prvku, v týchto prípadoch ide o izotopy. Napríklad diamant a uhlík sú látky vyrobené z chemického prvku uhlík (C). ale je to organizované rôznymi spôsobmi a výsledkom sú dva úplne odlišné materiály.
Carl sagan Povedalo to, že sme hviezdny prach odrážajúci hviezdy. Táto krásna fráza nie je iba metaforou, ale vedeckým faktom. Pokiaľ vieme, chemické prvky vo vnútri hviezd sú výsledkom komplexu fúzne a atómové štiepne procesy, ktoré generujú stále ťažšie prvky, výsledok procesu tzv nukleosyntéza.
Väčšinu známych prvkov je možné získať z prírody, nachádzajúce sa spontánne alebo vytvárajúce zlúčeniny s inými prvkami, ako je urán (U), uhlík (C), kremík (Si), striebro (Ag) alebo zlato (Au). Ostatné boli naopak vyrobené v laboratóriách, ako sú americium (Am), berkelium (Bk) alebo curium (Cm). Bez ohľadu na spôsob jeho získania alebo ak je prítomný v prírode, v závislosti od jeho vlastností bude mať príslušný chemický prvok určité alebo iné použitia.
V súčasnosti je známych asi 118 chemických prvkov, aj keď vzhľadom na to, že ľudia boli schopní vyrábať nové prvky, je otázkou času, kedy sa periodická tabuľka rozšíri.
- Mohlo by vás zaujímať: „Dva druhy elektriny (vysvetlené)“
Hlavné typy chemických prvkov
Hlavné typy chemických prvkov sú zastúpené v periodickej tabuľke systémov klasifikácia vytvorená ruským chemikom Dmitrijom Mendelejevom (1834-1907), ktorý položil základy v r 1869. Chemické prvky sú vizuálne usporiadané na základe ich vlastností a vlastností.
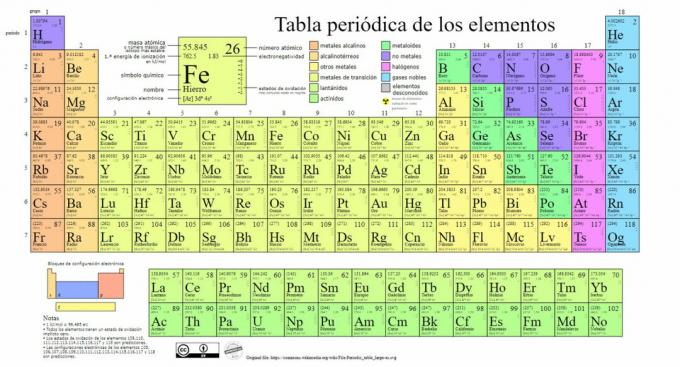
V priebehu času a vzhľadom na to, že chémia priniesla dôležité vedecké objavy, sa táto tabuľka bude postupne rozširovať, pričom do dnešnej podoby dosahuje 118 doposiaľ známych prvkov.
V súčasnej dobe v tejto tabuľke nájdeme nasledujúce typy chemických prvkov:
1. Kovy
Kovy sú chemické prvky, ktoré spravidla obsahujú jeden až tri elektróny na poslednej obežnej dráhe svojho atómu, elektróny, ktoré je možné ľahko prenášať čo z nich robí vodiče tepla a elektriny.
Kovy sú zvyčajne tvárne a tvárné, s charakteristickým leskom, ktorého intenzita závisí od pohybu elektrónov, ktoré tvoria ich atómy. Kovy sú väčšinou pri izbovej teplote pevné, okrem ortuti.
Medzi kovmi nájdeme zlato (Au), striebro (Ag), meď (Cu) a hliník (Al), ktorých fyzikálne vlastnosti z nich robia veľkolepé vodiče elektriny, aj keď je ich prítomnosť v prírode veľmi pestrá, odzrkadľuje sa to na rozdiele medzi ich hmotnosťami.
Verí sa, že 75% chemických prvkov existujúcich v prírode sú kovy, zatiaľ čo zvyšných 25% je tvorených vzácnymi plynmi, metaloidmi a inými druhmi.
V tejto kategórii existujú klasifikácie, ktoré obsahujú aktinidy, lantanoidy, prechodné kovy, alkalické kovy, kovy alkalických zemín a ďalšie kovy.
- Súvisiaci článok: „10 potravín s vysokým obsahom zinku“
1.1. Lanthanoidy
Prvky lantanoidu sa nachádzajú v ložiskách tvorených mnohými minerálmi. Sú to biele kovy, ktoré pri kontakte so vzduchom ľahko oxidujú. Medzi nimi nájdeme Lanthanum (La), Promethium (Pm), Europium (Eu) a Ytterbium (Yb).

- Mohlo by vás zaujímať: „5 typov chemických väzieb: takto sa skladá hmota“
1.2. Aktinidy
Všetky izotopy aktinidov sú rádioaktívne. Nájdeme medzi nimi aktinium (Ac), urán (U), plutonium (Pu) a einsteinium (Es).
1.3. Prechodné kovy
Prechodné kovy sa nachádzajú v centrálnej časti periodickej sústavy. Jeho hlavnou charakteristikou je, že majú elektronickú konfiguráciu orbitálu „d“ čiastočne naplnenú elektrónmi.
V tejto skupine sú látky všetkých druhov a podľa najširšej klasifikácie by zodpovedali chemickým prvkom od 21 do 30, od 39 do 48, od 71 do 80 a od 103 do 112, čo je spolu štyridsať, a našli by sme medzi nimi vanád (V), ruténium (Ru), striebro (Ag), tantal (Ta) a lawrencio (Lr).

1.4. Alkalické kovy
Alkalické kovy sú skupinou šiestich prvkov zložených z lítia (Li), sodíka (Na), draslíka (K), rubídia (Rb), cézia (Cs) a francia (Fr). Sú lesklé, mäkké kovy, pri normálnej teplote a tlaku veľmi reaktívne a ľahko strácajú vonkajší elektrón, ktorý sa nachádza v ich orbitáli „s“.
1,5. Alkalické zeminy
Kovy alkalických zemín sú skupinou prvkov, v ktorých nájdeme berýlium (Be), horčík (Mg), vápnik (Ca), stroncium (Sr), bárium (Ba) a rádium (Ra). Jeho názov pochádza z názvu jeho oxidov, „zemín“, ktoré majú zásadité alebo zásadité vlastnosti.
Alkalické zeminy sú tvrdšie ako zásadité, lesknú sa a sú dobrými elektrickými vodičmi. Sú menej reaktívne ako zásadité a pôsobia ako dobré redukčné činidlá. Majú schopnosť vytvárať iónové zlúčeniny a všetky majú vo svojom najvzdialenejšom obale dva elektróny.

1.6. Ostatné kovy
Kategória „ostatné kovy“ je druh látok, ktoré sa tu nachádzajú, pretože vlastne neviete, kam ich zaradiť.
Sú to kovové prvky umiestnené v periodickej tabuľke spolu s metaloidmi v bloku p. Majú tendenciu byť mäkké s nízkymi teplotami topenia. Medzi nimi sú okrem iného hliník (Al), indium (In), cín (Sn) a bizmut (Bi).

2. Žiadne kovy
Nekovy majú vo všeobecnosti na poslednej obežnej dráhe päť až sedem elektrónov, čo je vlastnosť že namiesto toho, aby sa ich vzdali, získavajú elektróny, a teda sa im darí mať osem elektrónov, ktoré ich stabilizujú ako atómy.
Tieto prvky sú veľmi zlými vodičmi tepla a elektriny. Okrem toho nemajú charakteristický lesk, nie sú veľmi kujné, nie sú veľmi tvárne a v tuhom stave sú veľmi krehké. Na rozdiel od kovov sa nedajú valcovať ani napínať.
Sú väčšinou nevyhnutné pre biologické systémy, pretože sú prítomné v organické zlúčeniny, ako je síra (S), uhlík (C), kyslík (O), vodík (H) a jód (I).

- Súvisiaci článok: „20 druhov drahých kameňov (popísaných a s obrázkami)“
3. Metaloidy
Ako naznačuje ich názov, metaloidy sú stredná klasifikácia medzi kovmi a nekovmi, ktoré majú vlastnosti oboch skupín. Dôvodom je skutočnosť, že na poslednej obežnej dráhe majú štyri atómy, čo je medziprodukt k množstvu kovov a nekovov.
Tieto chemické prvky vedú elektrický prúd iba v jednom smere, čo neumožňuje, aby sa uskutočňovalo v opačnom smere ako v kovoch. Príkladom toho je kremík (Si), metaloid, ktorý sa vďaka tejto vlastnosti používa na výrobu polovodičových prvkov pre elektronický priemysel.
Ďalšími metaloidmi sú: bór (B), arzén (As), antimón (Sb) a polónium (Po).

4. Halogény
Halogény sú skupinou šiestich prvkov, ktoré majú tendenciu vytvárať molekuly zložené z dvoch atómov (diatomických) veľmi chemicky aktívnych kvôli svojej elektronegativite.
Tieto látky sa zvyčajne objavujú vo forme iónov, to znamená elektricky nabitých molekúl, ktoré sú v tomto prípade mononegatívne a silne oxidujúce. To znamená, že halogény sú žieravé a korozívne látky.
Halogénmi sú: fluór (F), chlór (Cl), bróm (Br), jód (I), astát (At) a tenes (Ts).

5. Vzácne plyny
Vzácne plyny sú skupinou siedmich, ktorých prirodzený stav je plynný. Obvykle sa objavujú vo forme rozsievkových molekúl s veľmi nízkou reaktivitou, to znamená, že nereagujú s inými prvkami tvoriacimi iné látky. a z rovnakého dôvodu sú známe ako inertné plyny. Dôvodom je, že na jeho poslednej obežnej dráhe je maximálny možný počet elektrónov pre túto úroveň, celkovo osem.
Táto vybraná skupina prvkov pozostáva z hélia (He), neónu (Ne), argónu (Ar), kryptónu (Kr), xenónu (Xe), radónu (Rn) a oganesónu (Og), predtým známeho ako ununoctium.

