MOLEKULARNA geometrija: opredelitev in primeri
The tridimenzionalna oblika v katerem so razporejeni atomi, ki sestavljajo molekulo, je znano po imenu molekularna geometrija ali molekularna struktura.
Iz teoretičnega modela je mogoče razbrati geometrijo teh molekul: model odbijanja parov elektronov v valentni lupini (RPECV). Ta model je še posebej uporaben za predstavitev geometrije molekul, sestavljenih iz majhnih atomov in povezanih s kovalentnimi vezmi (delitev elektronov).
V tej lekciji UČITELJA bomo odkrili opredelitev molekularne geometrije in primeri Tako lahko na ta način spoznate, iz česa je sestavljen model RPECV, kako lahko s to metodo ugotovite geometrijo molekul in nekaj primerov.
Kazalo
- Definicija molekularne geometrije
- Primeri molekularne geometrije
- Poznajte Lewisovo zgradbo molekule
- Model odbijanja elektronskih parov valentne lupine (RPECV)
Definicija molekularne geometrije.
Molekularna geometrija ali molekularna struktura je pot atomi našel molekulo so razporejeni v prostoru.
Prihaja ta tridimenzionalna struktura (molekularna geometrija) opredeljeno z vrsto sil ki držijo atome skupaj v določeni ureditvi. Med silami, ki določajo molekularno geometrijo, so najpomembnejše povezave da atomi ležali drug drugemu, da tvorijo molekulo.
Geometrija molekul je zelo pomembna ker določa, kakšne so fizikalno-kemijske značilnosti snovi. Na primer: molekule H2O imajo kotno geometrijo, ki jo določajo vezi, ki jo tvorijo. Če sprejmemo to kotno geometrijo, postane molekula vode električni dipol in ima izjemne lastnosti. Zahvaljujoč svoji geometriji je voda tekoča pri sobni temperaturi, lahko raztopi številne snovi itd.
Očitno glede na velikost molekul njihove geometrije ni mogoče neposredno opazovati in jo je treba določiti s posrednimi metodami. Poleg tega je treba te geometrije predstaviti s teoretičnimi modeli.
Ti teoretični modeli nam omogočajo, da po molekulski formuli ugotovimo, kakšna je geometrija molekule.
Primeri molekularne geometrije.
Kot smo videli v prejšnjem poglavju, lahko atomi, ki tvorijo molekulo, pridobijo različne prostorske ureditve (geometrije). V tem poglavju bomo videli nekaj primerov molekularne geometrije.
Dvodimenzionalne geometrije
V nekaterih primerih molekule pridobijo ravne ali dvodimenzionalne geometrije, to pomeni, da so strukture, ki imajo le dve dimenziji in zasedajo površino (nimajo prostornine).
Linearna geometrija
Gre za najpreprostejšo geometrijo, gre za molekule, katerih atomi so združeni v ravno črto. Vse molekule, sestavljene iz dveh atomov, so linearne, vendar se ta geometrija pojavlja tudi v molekulah, sestavljenih iz treh atomov.
Primeri linearnih molekul:
Tvorita ga dva atoma: vsi dvoatomski plini, kot sta O2, H2.
Sestavljen iz treh atomov: CO2 (ogljikov dioksid).
Kotna geometrija
So molekule, sestavljene iz treh atomov, ki se združujejo pod kotom. Amplituda oblikovanega kota je lahko različna, odvisno od vrste atomov, ki ga tvorijo. Amplitude kotov, ki jih tvorijo kotne molekule, imajo vrednosti med 90 ° in 120 °.
Primeri: H2O, SO2 (žveplov dioksid), SnCl2 (kositer diklorid)
Trikotna geometrija
So molekule, sestavljene iz štirih atomov, pri čemer se en atom nahaja v središču namišljenega trikotnika, drugi trije preostali atomi pa se nahajajo v vsaki točki tega trikotnika.
Primeri: SO3 (žveplov trioksid), NO3- (nitratni ion)
Kvadratna geometrija
Molekule s to geometrijo imajo 5 atomov. Ena se nahaja v središču kvadrata, druga 4 pa v vsaki točki slike.
Primeri: XeF4 (ksenonski trifluorid)
Tridimenzionalne geometrije
Imajo tri dimenzije, torej imajo prostornino. Geometrija 3D molekul je zelo raznolika, tukaj bomo videli le nekaj primerov.
Tetraedrična geometrija
Ta geometrija je tista, v kateri je prisotnih nekaj molekul, ki jih tvori pet atomov, v njej pa je atom središče namišljene kocke in štirje preostali atomi se nahajajo na ogliščih kocke (tetraeder).
Primer: CH4 (metan), MnO4-(permanganatni ion)
Trigonalna piramidalna geometrija
So molekule s štirimi atomi, razporejenimi na štirih točkah piramide s trikotno osnovo.
Primer: NH3 (amoniak), PH3 (fosfin)
Štirikotna piramidalna geometrija
V tem primeru je število atomov, ki sestavljajo molekulo, šest in pet jih je razporejenih v oglišča piramide s kvadratno osnovo, medtem ko šesta zaseda središče kvadrata osnova.
Primer: ClF5 (klorov pentafluorid)
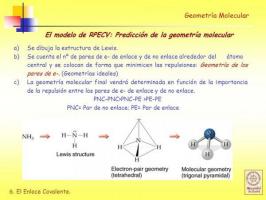
Poznajte Lewisovo zgradbo molekule.
Preden lahko uporabite Metoda RPECV treba je vedeti, kaj je to Lewisova struktura molekule in za to morate najprej vedeti, kaj elektronska konfiguracijaiz plasti Valencia različnih atomov, ki sestavljajo molekulo.
Preden lahko določimo geometrijo molekule, moramo izvesti nekaj predhodnih korakov:
- TO. Pridobite elektronske konfiguracije različnih atomov, ki sestavljajo molekulo.
- B. Določite število elektronov valentne lupine vsakega od atomov. Elektri v valentni lupini so elektroni, ki jih atom lahko uporabi za tvorbo vezi.
- C. Izvedite Lewisovo strukturo ob upoštevanju, koliko elektronov ima vsak atom v svoji valentni lupini.
Slika: Slideplayer
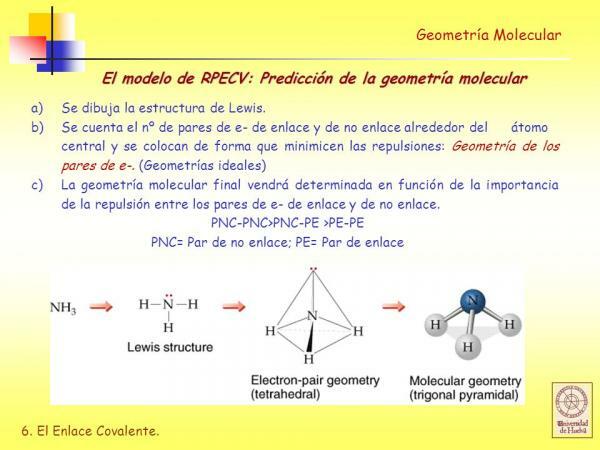
Model odbijanja elektronskih parov valentne lupine (RPECV)
V Lewisove strukture vsak izmed vezanih atomov mora izpolnjevati pravilo okteta. Ko atom izpolni pravilo okteta, je obdan s štirimi pari elektronov, ki so lahko elektroni, ki so del vez (vezni elektronski par) ali elektronski par, ki ne sodeluje pri tvorbi vezi (nevezni elektronski pari) zavezujoča).
Kot bomo videli, ugotovite Lewisovo strukturo molekule geometrija z uporabo modela odbijanja elektronskih parov valentne lupine je zelo enostavno.
V skladu s tem predstavitvenim modelom so ligandi (X) in nevezani elektronski pari (E) razporejeni okoli osrednjega atoma (A), tako da je razdalja med njimi največja. Vsota ligandov in nevezanih elektronskih parov (X + E) določa vrsto geometrije molekule.
X + E = 2
Linearna geometrija
AX2: Molekula, ki jo tvorita dva ligandna atoma, pritrjena na osrednji atom
Primer: berilijev hidrid (BeH2).
X + E = 3
Trikotna ravninska geometrija (enakostranični trikotnik)
AX3: Molekula, sestavljena iz treh atomov, pritrjenih na osrednji atom
Primeri: Nekateri kloridi, kot sta bor ali aluminij (BCl3, AlCl3)
Kotna geometrija (kot 120º)
AX2E: Molekula z osrednjim atomom, pritrjenim na dva liganda, in nevezanim elektronskim parom.
Primeri: kositer (II) klorid (Sn2Cl)
X + E = 4
Tetraedrična geometrija
AX4: Molekule s centralnim atomom s štirimi ligandi, razporejenimi v vezi, tako da so ligandi imajo na ogliščih nasprotnih diagonal kocko, katere središče je sam osrednji atom.
Primeri: Molekule, kot so metan (CH4), silicijev klorid (SiCl4) ali ogljikov tetraklorid (CCl4), predstavljajo to geometrijo.
Trigonalna piramidna geometrija
AX3E: Molekule s 3 ligandi in 1 samotnim elektronskim parom, v katerem so razporejeni atomi treh ligandov osnova piramide s trikotno osnovo, v kateri je osrednji atom v zgornji točki omenjenega piramida
Primeri: ena od molekul s to geometrijo je amoniak (NH3).
Kotna geometrija (kot 109º)
AX2E2: Dva liganda in osrednji atom sta razporejena tako, da tvorita kot 109º
Primeri: Voda (H2O) je ena izmed molekul, ki imajo to geometrijo.
Glinearna eometrija
AX3: Ker je na osrednji atom vezan samo en ligand, je geometrija linearna.
Primer: vodikov fluorid ali fluorovodikova kislina (HF).
X + E = 5
Trigonalna bipiramidna geometrija
AX5: Molekula ima geometrijo dveh nasprotujočih si piramid s trikotno osnovo, ki je skupna obema. Osrednji atom je razporejen v središču, ligandi pa se nahajajo na ogliščih.
Primer: fosforjev pentaklorid (PCl5)
Dishenoidna geometrija
AX4E: Pri tej vrsti geometrije atomi dobijo razporeditev, ki spominja na zgradbo nihajne nihaje.
Primer: Tetra žveplov fluorid (SF4).
T geometrija
AX3E2: Molekule so oblikovane kot črka T, z ligandi na koncih črke in osrednjim atomom na mestu, kjer se stikata dve črti, ki jo tvorita.
Primer: klorov trifluorid (ClF3)
Linearna geometrija
AX2E3: V tem primeru so trije atomi molekule v vmesnem položaju razporejeni poravnani s centralnim atomom.
Primer: ksenonski difluorid (F2Xe)
X + E = 6
Osmerokotna geometrija
AX6: Ta vrsta molekul ima strukturo, ki spominja na oktaeder, v katerem bi osrednji atom zasedel središče geometrijske figure in šest ligandov v vsaki njeni točki.
Primer: žveplov heksafluorid (SF6)
Kvadratna osnovna piramida
AX5E: V tem primeru atomi tvorijo figuro, v kateri osrednji atom zaseda središče osnove, ligandi pa pet točk slike.
Primer: bromov pentafluorid (BrF5)
Ravna kvadratna geometrija
AX4E2: Atomi dobijo razporeditev kvadratne oblike, v katerem osrednji atom zavzame središče figure in ligandi vsako od njenih točk.
Primer: ksenonski tetrafluoridni ion (XeF4)

Če želite prebrati več podobnih člankov Molekularna geometrija: opredelitev in primeri, priporočamo, da vnesete našo kategorijo Atom.
Bibliografija
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Osnovna kemija. Madrid: Uned