10 vrst kemičnih elementov (razloženih in razvrščenih)
Koliko kemičnih elementov mora obstajati v vesolju? To vprašanje ima še dolgo pot, saj znanstveniki občasno ustvarjajo svoje umetne kemične elemente.
Na kar pa lahko odgovorimo je koliko vrst kemičnih elementov mora obstajati, nekaj, kar bomo izvedeli v nadaljevanju.
- Sorodni članek: "11 vrst kemičnih reakcij"
Vrste kemičnih elementov
V naravi lahko najdemo vse vrste snovi. Teh snovi običajno ne najdemo v čistem stanju, ampak so rezultat kombinacije različnih elementi ali materiali, ki so zaradi različnih reakcij, procesov in časovnih obdobij povzročili vse vrste zadeva. V vesolju ni ničesar, kar ne bi bilo posledica kombinacije atomov, ki pripadajo različnim vrstam kemičnih elementov, ki ga bomo poglobljeno videli.
Preden pa pogledamo vrste kemičnih elementov, naredimo majhen pregled srednješolske znanosti in se spomnimo, kaj so kemični elementi.
Imenujemo "kemični element" snov, ki je sestavljena iz iste vrste atoma, to je snovi, ki je atomsko čista. Kemičnih elementov ni mogoče razgraditi na enostavnejše in so razvrščeni v periodni sistem elementov kot čistih materialov vesolja.
Ampak pozor! Ne smemo zamenjati elementov s preprostimi snovmi, saj lahko v določenih primerih sestavljata dva ali več atomov istega elementa molekule, združene na različne načine, zaradi česar se nekatere fizikalne lastnosti zadevnega elementa razlikujejo, pri čemer gre za te primere izotopi. Na primer, diamant in ogljik sta snovi iz kemičnega elementa ogljika (C). vendar je to organizirano na različne načine in ima za posledico dva popolnoma različna materiala.
Carl sagan Rečeno je, da smo zvezdni prah, ki odseva zvezde. Ta lepa fraza ni zgolj metafora, ampak znanstveno dejstvo. Kolikor vemo, kemični elementi nastajajo v notranjosti zvezd zaradi kompleksnosti fuzijski in atomski cepitveni procesi, ki ustvarjajo vse težje elemente, rezultat procesa, imenovanega nukleosinteza.
Večino znanih elementov je mogoče pridobiti iz narave, najdemo spontano ali tvorijo spojine z drugimi elementi, kot so uran (U), ogljik (C), silicij (Si), srebro (Ag) ali zlato (Au). Drugi pa so bili proizvedeni v laboratorijih, kot so americij (Am), berkelij (Bk) ali kurij (Cm). Ne glede na način pridobivanja ali če je prisoten v naravi, bo imel zadevni kemijski element določeno ali drugo uporabo.
Trenutno je znanih približno 118 kemičnih elementov, čeprav je ob upoštevanju, da so ljudje lahko izdelali nove elemente, le vprašanje časa, preden se periodni sistem razširi.
- Morda vas zanima: "2 vrsti električne energije (pojasnjeno)"
Glavne vrste kemičnih elementov
Glavne vrste kemičnih elementov so predstavljene v periodnem sistemu, sistemu klasifikacijo, ki jo je ustvaril ruski kemik Dmitri Mendeleev (1834-1907), ki je svoje temelje postavil leta 1869. Kemični elementi so vizualno urejeni glede na njihove lastnosti in lastnosti.
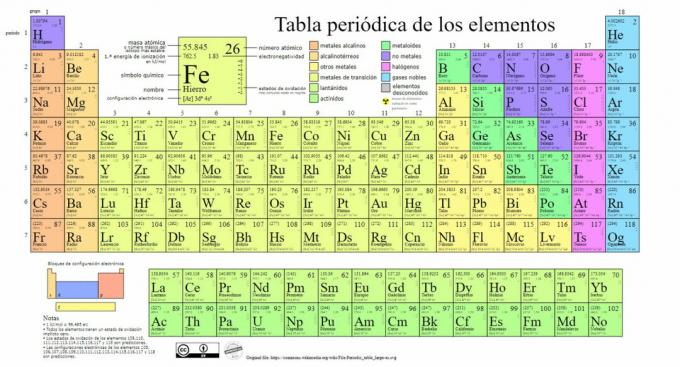
Sčasoma in ko je kemija pripeljala do pomembnih znanstvenih odkritij, bi to tabelo zaporedno širili, ki je s 118 doslej znanimi elementi dosegel današnjo obliko.
Trenutno v tej tabeli lahko najdemo naslednje vrste kemičnih elementov:
1. Kovine
Kovine so kemični elementi, ki običajno vsebujejo med enim in tremi elektroni v zadnji orbiti svojega atoma, elektroni, ki jih je mogoče enostavno prenesti zaradi česar so prevodniki toplote in električne energije.
Kovine so običajno voljne in duktilne, z značilnim sijajem, katerega intenzivnost je odvisna od gibanja elektronov, ki sestavljajo njihove atome. Kovine so pri sobni temperaturi večinoma trdne, razen živega srebra.
Med kovinami najdemo zlato (Au), srebro (Ag), baker (Cu) in aluminij (Al), zaradi katerih so fizikalne lastnosti čudoviti prevodniki električne energije, čeprav je njihova prisotnost v naravi zelo raznolika, kar se odraža v razliki med njihovo težo.
Menijo, da je 75% kemičnih elementov, ki obstajajo v naravi, kovine, preostalih 25% pa bi predstavljali plemeniti plini, metaloidi in druge vrste.
V tej kategoriji obstajajo klasifikacije, ki odkrivajo aktinide, lantanide, prehodne kovine, alkalne kovine, zemeljskoalkalijske kovine in druge kovine.
- Sorodni članek: "10 živil z visoko vsebnostjo cinka"
1.1. Lantanidi
Elemente lantanida najdemo v nahajališčih, sestavljenih iz številnih mineralov. So bele kovine, ki v stiku z zrakom zlahka oksidirajo. Med njimi najdemo lantan (La), prometij (Pm), evropij (Eu) in iterbij (Yb).

- Morda vas zanima: "5 vrst kemičnih vezi: tako je sestavljena snov"
1.2. Actinidi
Vsi izotopi aktinidov so radioaktivni. Med njimi najdemo aktin (Ac), uran (U), plutonij (Pu) in einsteinij (Es).
1.3. Prehodne kovine
Prehodne kovine se nahajajo v osrednjem delu periodičnega sistema. Njegova glavna značilnost je, da imajo elektronsko konfiguracijo "d" orbite, ki je delno napolnjena z elektroni.
V tej skupini so snovi vseh vrst in bi po najširši klasifikaciji ustrezale kemičnim elementom od 21 do 30, od 39 do 48, od 71 do 80 in od 103 do 112, kar je skupaj štirideset in med njimi bi našli vanadij (V), rutenij (Ru), srebro (Ag), tantal (Ta) in lawrencio (Lr).

1.4. Alkalne kovine
Alkalne kovine so skupina šestih elementov, sestavljenih iz litija (Li), natrija (Na), kalija (K), rubidija (Rb), cezija (Cs) in francija (Fr). So sijoče, mehke kovine, zelo reaktivne pri normalni temperaturi in tlaku ter zlahka izgubijo zunanji elektron, ki se nahaja v njihovi "s" orbiti.
1.5. Alkalne zemlje
Zemeljskoalkalijske kovine so skupina elementov, v katerih najdemo berilij (Be), magnezij (Mg), kalcij (Ca), stroncij (Sr), barij (Ba) in radij (Ra). Njegovo ime izvira iz imena oksidov, "zemelj", ki imajo osnovne ali alkalne lastnosti.
Alkalne zemlje trši so od alkalnih, svetijo in so dobri električni prevodniki. So manj reaktivni od alkalnih in delujejo kot dobra redukcijska sredstva. Imajo sposobnost tvorjenja ionskih spojin in vsi imajo v svoji zunanji lupini dva elektrona.

1.6. Druge kovine
Kategorija "druge kovine" je vrsta snovi, ki jih najdemo tukaj, ker v resnici ne veste, kam jih dati.
So kovinski elementi, ki se nahajajo v periodnem sistemu skupaj z metaloidi v bloku p. Ponavadi so mehki z nizkimi tališči. Med njimi so med drugim aluminij (Al), indij (In), kositer (Sn) in bizmut (Bi).

2. Brez kovin
Nekovine imajo na zadnji orbiti običajno od pet do sedem elektronov, kar je lastnost da pridobijo elektrone, namesto da bi se jim odrekli, in jim tako uspe imeti osem elektronov, ki jih tako stabilizirajo kot atomov.
Ti elementi so zelo slabi prevodniki toplote in električne energije. Poleg tega nimajo značilnega sijaja, niso zelo voljne, niso zelo duktilne in so v trdnem stanju zelo krhke. Za razliko od kovin jih ni mogoče valjati ali raztezati.
Najpomembnejši so za biološke sisteme, saj so prisotni v organske spojine, kot so žveplo (S), ogljik (C), kisik (O), vodik (H) in jod (I).

- Sorodni članek: "20 vrst dragih kamnov (opisanih in s slikami)"
3. Metaloidi
Kot že ime pove, so metaloidi vmesna razvrstitev med kovinami in nekovinami, ki imajo lastnosti obeh skupin. To je posledica dejstva, da imajo v zadnji orbiti štiri atome, vmesno količino kovin in nekovin.
Ti kemični elementi prevajajo električno energijo samo v eno smer, pri čemer ne dopuščajo, da bi potekala v nasprotni smeri, kot pri kovinah. Primer tega najdemo v siliciju (Si), metaloidu, ki se zaradi te lastnosti uporablja v proizvodnji polprevodniških elementov za elektronsko industrijo.
Drugi metaloidi so: bor (B), arzen (As), antimon (Sb) in polonij (Po).

4. Halogeni
Halogeni so skupina šestih elementov, ki ponavadi tvorijo molekule, sestavljene iz dveh atomov (dvoatomnih), ki sta zaradi svoje elektronegativnosti zelo kemično aktivni.
Te snovi se običajno pojavljajo v obliki ionov, to je električno nabitih molekul, ki so v tem primeru mononegativne in močno oksidirajo. To pomeni, da so halogeni jedke in jedke snovi.
Halogeni so: fluor (F), klor (Cl), brom (Br), jod (I), astat (At) in tenes (Ts).

5. Plemeniti plini
Plemeniti plini so skupina sedmih, katerih naravno stanje je plinasto. Običajno se pojavljajo v obliki dvoatomičnih molekul z zelo nizko reaktivnostjo, torej ne reagirajo z drugimi elementi, ki sestavljajo druge snovi in iz istega razloga so znani kot inertni plini. To je zato, ker je v zadnji orbiti največje število elektronov za to raven, skupaj osem.
To izbrano skupino elementov sestavljajo helij (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe), radon (Rn) in oganeson (Og), prej znan kot ununokcij.

