Hur får man MASSIKNUMMER?

Atomer är en del av all materia som utgör universum. Materien är väldigt varierad eftersom den består av olika typer av atomer, med olika egenskaper och egenskaper. Egenskaperna hos de olika atomerna ges av partiklarna som bildar dem: protoner, elektroner och neutroner. De olika proportionerna mellan den ena och den andra definieras i kemi med olika namn (massnummer, atomnummer etc.). Massantalet ger oss det slutliga eller totala antalet partiklar i kärnan, eller vad är detsamma, det är göra summan mellan protoner och neutroner, och används i kemi för att skilja isotop av ett element kemisk.
I den här lektionen från en LÄRARE kommer vi att se massnummer, hur man får det, vad det exakt är och vad det används till.
Index
- Vad är massnummer?
- Massnummer och isotoper
- Hur beräknar man massantalet? - Formel
Vad är massnummer?
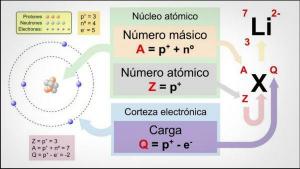
De massnummer det är inget mer än summan av protoner och neutroner, det vill säga alla partiklar som finns i kärnan (kom ihåg att elektronerna kretsar runt kärnan och bildar skorpan).
Massnumret skrivs med bokstaven A och det anges i en superscript-situation, alltid till vänster om symbolen som indikerar elementet vi har att göra med, det är det vill säga vi kommer att hitta det som ett litet tal som placeras till vänster om elementets symbol, högst upp på detta. Det representerar atomens massa uppmätt i uma (atommasseenhet) eftersom elektronernas massa är väldigt liten, den är så liten att den kan ignoreras eller försummas.
Massantalet atomer är vanligtvis van vid differentiera isotoper av ett kemiskt grundämne.

Bild: Bildspel
Massnummer och isotoper.
Isotoper är varianter av samma kemiska element som har olika mängder neutroner så skiljer sig åt i massnummer. Isotoper kan förekomma normalt i naturen (naturliga isotoper) eller vara helt konstgjorda (artificiella isotoper). Exempel på isotoper i naturen är de av kol:
Kol förekommer som en blandning av tre isotoper med massnummer 12, 13 och 14: 12C, 13C och 14C.
Isotoper har många användningsområden: de används för cancerbehandlingar, bestämmer utseendet för gifter i vävnader som arsenik, markörer för kemiska reaktioner etc.
Var och en av isotoperna i ett kemiskt element kan ha olika egenskaper. En av de mest kända och använda egenskaperna är den konstanta halveringstiden för halveringstiden eller halveringstid. Halveringstiden för en isotop är den tid som krävs för att halva kärnorna i ett första prov av en radioisotop ska gå sönder. I praktiken tenderar isotoper att sönderdelas och förändras från mindre stabila former till mer stabila former. stabil, så detta kan också förstås som den tid det tar att transmutera eller transformera hälften av atomerna radioaktivt från ett prov. Halveringstiden för kol-14, som blir kol-12, är mycket lång och används för att datera gamla organiska rester som fossil. Däremot är halveringstiden för andra isotoper som syre-15 bara sekunder (122 sekunder, för att vara exakt).
När det gäller väte är dess naturliga isotoper de har mycket olika egenskaper och egenskaper, varför de har tre olika namn: konventionellt väte eller protium 1H, deuterium 2H (D) och tritium 3H (T). Väte har andra konstgjorda isotoper (väte-4, väte-5, etc.).

Bild: Bildspel
Hur beräknar man massantalet? - Formel.
För att beräkna massatalet för en atom eller jon vi måste lägga till atomnumret (antalet protoner i en atom eller jon, normalt representerat som "Z") och antalet elektroner.
Massnummer (A) = atomnummer (Z) + antal neutroner (N)
TILL = Z + N
Atomtalet finns i elementens periodiska system, längst upp till vänster om vart och ett av elementen. Massnummer eller atommassa visas också under elementet i det periodiska systemet.
Därför, genom att subtrahera atomnumret från massantalet, kan vi också veta antalet protoner.
Antal neutroner (N) = massnummer (A) - atomnummer (Z)
N = A - Z
Om du till exempel konsulterar ett periodiskt system ser du att järn har ett massnummer på 55,84, det vill säga A = 56 avrundat till närmaste enhet; Dess atomnummer (Z) är 26, så antalet neutroner kommer att vara:
N = A - Z = 56-26 = 30
Om du vill läsa fler artiklar som liknar Hur får man massnummer?rekommenderar vi att du anger vår kategori av Atomen.