Vad är KEMISKA FORMLER och vad är de för [SAMMANFATTNING + VIDEOS]
Även om det inte verkar, de kemiska grundämnena i det periodiska systemet De omger oss på alla sidor. Men många gånger hittas de inte separat, utan bildar snarare molekyler eller makromolekyler av olika kemiska grundämnen. Kemiska formler är det grafiska uttrycket för dessa föreningar och används för att standardisera deras nomenklatur. I den här lektionen från en LÄRARE kommer vi att se vad är kemiska formler och vad är de till för. Gå med oss för att ta reda på mer!
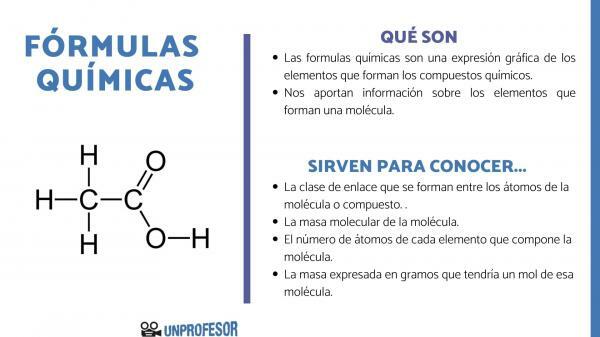
De kemiska formler är ett grafiskt uttryck för de element som utgör kemiska föreningar.
Dessa kemiska formler är inte godtyckliga, men följer några strikta regler kemisk nomenklatur, fastställd av IUPAC (International Union of Pure and Applied Chemistry).
Kemiska formler ger oss också information om element som utgör en molekyl, alltså, till exempel, berättar den för oss antalet och respektive proportioner av var och en av atomerna som utgör den och ibland även typen av Kemisk bindning som finns mellan dessa element.
Varje molekyl eller makromolekyl som existerar motsvarar dess kemiska formel, hur den än finns
olika typer av formler. Var och en av dessa typer ger oss olika information om molekylen, men de hjälper oss alla att förstå dess kemisk natur och det hjälper oss att förstå vad som händer i kemiska reaktioner och hur en förening kan omvandlas till andra.Men för att förstå denna kemiska nomenklatur är det nödvändigt att ha vissa kunskaper i kemi, eftersom de lyder ett ganska specialiserat tekniskt språk.

Bild: Slideplayer
De kemiska formler representeras av förening av kemiska symboler, med motsvarande bokstav för varje atom som den kommer i periodiska systemet, och prenumerationer, som är siffror som representerar mängden av dessa atomer i molekylen
Inom kemin (både organisk och oorganisk) finns vissa fragment eller föreningar som visar ett visst återfall både strukturellt och funktionellt och identifieras med namn specifika. När dessa fragment har fria elektroner som inte delas kallas de för radikaler och de är instabila, mycket reaktiva föreningar med kort halveringstid.
Exempel på radikaler är metylgrupper CH3, nitratgrupper NO3, hydroxylgrupper OH- eller radikalen Cl-. Men de är kända som funktionella grupper när de är atomer eller grupper av atomer fästa till en kedja koldioxid (med olika kol) och som är ansvariga för reaktivitet och kemiska egenskaper hos molekyler.
Dessa grupper är särskilt viktiga inom organisk kemi (mänskliga biomolekyler är i grunden kol och väte). Några exempel på funktionella grupper är karbonylgruppen = C = O eller karboxylgruppen -COOH.

Bild: Monogramas.com
Som vi sa, det finns flera typer av kemiska formler. Var och en av dessa formler ger oss olika typer av information om molekylerna och därför den tjänar ett visst mål, utan att någon formel är bättre eller sämre än en annan i allmänna termer.
Klasserna av kemiska formler som vi särskiljer är:
Empiriska formler
Empiriska formler är de enklaste formlerna för att representera en kemisk molekyl, ibland säger de att de är minimala formler. Dessa formler representerar andelen atomer i vart och ett av grundämnena i molekylen, som är förenklade till heltal, alltid de minsta. Ett exempel på denna formel är CH3 (metylgrupp), med tre väteatomer och en kolatom.
Dessa formler kan dock ibland ge missuppfattningar om molekylens sammansättning. Detta inträffar när formeln inte anger det faktiska antalet atomer i molekylen, som med peroxid väte, vars empiriska formel är H2O när formeln ska vara H2O2 (två väteatomer och två av syre). Detta sker alltså genom en nomenklaturkonvention, eftersom båda teckningarna är lika, förenklas de.
Vissa föreningar kan dock endast representeras av empiriska formler, eftersom de är uppbyggda av jonnätverk. Detta sker till exempel i vanligt salt eller natriumklorid, som representeras som NaCl, vilket indikerar att det för varje natrium finns en klor.
Molekylära formler
Dessa typer av formler är ganska grundläggande, de uttrycker helt enkelt typen av atomer och antalet av varje närvarande i en kovalent molekyl. De är formler som presenterar de kemiska elementen och numret på ett linjärt sätt (i form av en nedsänkt text. Ett exempel på denna typ av formel är när glukos heter C6H12O6, vilket uttrycker att glukos Glukosmolekylen består av sex kolatomer, tolv väteatomer och sex av syre.
Molekylformler används ofta, ibland säger man att de är de sanna formlerna för molekyler. I många fall sammanfaller de med de empiriska formlerna, till exempel i CO2.
Halvutvecklade formler
Halvutvecklade formler är en typ av formler som liknar molekylformler, eftersom de också uttrycker atomerna som utgör molekylen och deras antal, men också ge information om kemiska bindningar (representerade av linjer mellan atomer) och typen av bindning mellan kolatomerna som bildar den (om de är enkla, dubbla eller trippel). Den semi-utvecklade formeln är användbar för att identifiera radikalerna som utgör molekylen och dess kemiska struktur (bindningarna mellan kol- och väteatomerna är inte representerade).
När det gäller glukos är dess semi-utvecklade formel CH2OH - CHOH - CHOH - CHOH -CHOH - CHO och som kan ses atomerna av kol, väte och syre är samma som i molekylformeln (sex, tolv respektive sex) och alla enkelbindningar (glukos har bara bindningar enkel). Denna formel är därför en mer komplex formel än molekylformeln.
Halvutvecklade formler kallas ibland för kondenserade och är kanske den mest använda formlerklassen. används, särskilt inom organisk kemi, även om de inte tillåter oss att observera molekylernas verkliga geometri.
Utvecklad formel
De utvecklade formlerna är lite mer komplexa än de semi-utvecklade. I denna typ av formler representeras bindningen och platsen för varje atom i molekylen i ett kartesiskt plan, tills hela föreningen är representerad.
Strukturformel
Strukturformeln är en grafisk representation av molekylens struktur i rymden, som ger oss information om ordningen och fördelningen av atomer i rymden. I denna formel visas också de kemiska bindningarna som utgör molekylen och om de är enkla, dubbla eller trippel. Denna formel är därför den som ger oss mest information om molekylen.
Dessa typer av formler används mer på professionell nivå inom kemivärlden, eftersom de tillåter att mycket tydligare se de kemiska reaktionerna eller syntesen av nya molekyler.
Lewis formler
Dessa är komplexa, mycket specifika och tekniska formler. De är också kända som Lewis-diagram eller strukturer och liknar de utvecklade formlerna för molekyler, men Dessutom anges de elektroner som atomerna delar i varje kemisk bindning, vilka varierar med atomernas valens inblandade.
I dessa formler representeras bindningarna mellan atomer av linjer (som också anger om de är enkla, dubbla eller trippel) eller med ett par prickar. De ensamma elektronerna eller elektronerna som inte delas i bindningen, representeras av punkter runt den atom som den motsvarar.

Bild: Organisk kemi
När man skriver formler hänvisas ibland tilloxidationstal av grundämnet (det är frekvent i joniska föreningar). Dessa är en uppsättning positiva och negativa siffror som går associerade med varje element.
- Oxidationstalen kan tolkas som antal elektroner att ett grundämne delar i en kovalent bindning eller överförs i en jonbindning.
- När oxidationstecknet ovanför atomen är negativ, betyder att detta element fångar elektroner och antalet som följer med det bredvid är antalet fångade elektroner. Därför betyder ett oxidationstillstånd på -1 att grundämnet plockar upp en elektron, -2 som plockar upp två, och så vidare.
- När tecknet på oxidation är positiv, atomen ger upp en elektron och talet som åtföljer detta tecken är antalet avgivna elektroner. På liknande sätt betyder ett oxidationstillstånd på +1 att det ger en elektron, +2 att det ger två, och så vidare.
Detta fungerar mest för joniska föreningar, i kovalenta bindningar, även om tolkningen är likartad, är den inte densamma eftersom dessa bindningar delar elektroner. I dessa föreningar talar vi om mer elektronegativa element, som drar mer av det elektroniska paret och lämnas med en mer negativ laddning, beroende på antalet elektroner det attraherar. Detta kan ses i Lewis formler.
Om du vill veta vad kemiska formler är till för måste du ta hänsyn till att detta nummer gör att vi kan få några molekylinformation, som de är:
- De länkklass som bildas mellan atomerna i molekylen eller föreningen. Dessa bindningar är normalt kovalenta när icke-metalliska och joniska atomer deltar i det om de är metalliska och icke-metalliska bindningar.
- De molekylär massa av molekylen.
- De antal atomer av varje grundämne som utgör molekylen. Det kallas ibland den centesimala sammansättningen av molekylen.
- Massan uttryckt i gram som skulle ha en mol av den molekylen.
När det gäller en jonförening, till exempel natriumklorid eller vanligt salt, är det inte strikt korrekt prata om molekyler (även om det ibland görs), att dessa tenderar att bilda stora aggregat och makromolekyler. I det här fallet hjälper föreningens formel oss att se vilka joner som bildar den och i vilken mängd.