ما هي الصيغ الكيميائية وما تستخدمه [ملخص + مقاطع فيديو]
على الرغم من أنه لا يبدو ، العناصر الكيميائية للجدول الدوري إنهم يحيطون بنا من جميع الجهات. ومع ذلك ، في كثير من الأحيان لا يتم العثور عليها بشكل منفصل ، ولكنها تشكل جزيئات أو جزيئات كبيرة من عناصر كيميائية مختلفة. الصيغ الكيميائية هي التعبير الرسومي لهذه المركبات وتستخدم من أجل توحيد تسمياتها. سنرى في هذا الدرس من المعلم ما هي الصيغ الكيميائية وما الغرض منها. انضم إلينا لمعرفة المزيد!
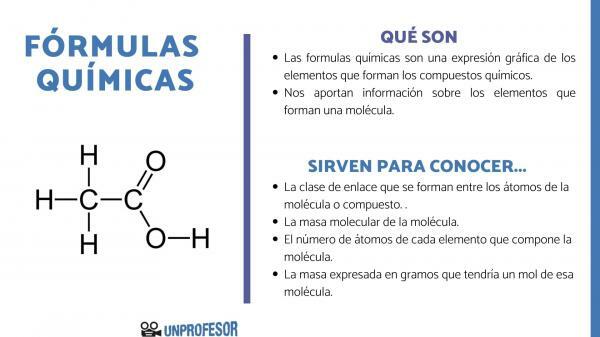
ال الصيغ الكيميائية هي تعبير رسومي للعناصر التي يتألف منها مركبات كيميائية.
هذه الصيغ الكيميائية ليست عشوائية ، ولكنها تتبع بعضها قواعد صارمة من التسميات الكيميائية ، التي أنشأتها IUPAC (الاتحاد الدولي للكيمياء البحتة و التطبيقية).
تزودنا الصيغ الكيميائية أيضًا بمعلومات حول العناصر التي تشكل الجزيء، وبالتالي ، على سبيل المثال ، يخبرنا العدد والنسب الخاصة بكل ذرة من الذرات التي تتكون منها ، وأحيانًا ، حتى نوع الرابطة الكيميائية الموجود بين تلك العناصر.
كل جزيء أو جزيء موجود يتوافق مع صيغته الكيميائية ، ولكن هناك أنواع مختلفة من الصيغ. كل نوع من هذه الأنواع يعطينا معلومات مختلفة عن الجزيء ، لكنهم جميعًا يساعدوننا في فهمه
الطبيعة الكيميائية ويساعدنا على فهم ما يحدث في التفاعلات الكيميائية وكيف يمكن لمركب ما أن يتحول إلى مركب آخر.ولكن من أجل فهم هذه التسميات الكيميائية ، من الضروري أن يكون لديك معرفة معينة في الكيمياء ، لأنها تتبع لغة تقنية متخصصة إلى حد ما.

الصورة: Slideplayer
ال الصيغ الكيميائية يمثلها اتحاد الرموز الكيميائية، مع الحرف المقابل لكل ذرة كما يأتي في الجدول الدوري، والمخطوطات ، وهي أرقام تمثل مقدار هذه الأرقام ذرات في الجزيء
داخل الكيمياء (العضوية وغير العضوية) توجد شظايا أو مركبات معينة تظهر تكرارًا معينًا بنيويًا ووظيفيًا ويتم تحديدها بواسطة الأسماء محدد. عندما تحتوي هذه الأجزاء على إلكترونات حرة غير مشتركة ، فإنها تسمى الجذور وهي مركبات غير مستقرة وعالية التفاعل مع نصف عمر قصير.
من الأمثلة على الراديكاليين مجموعات الميثيل CH3 ، مجموعات نترات NO3، مجموعات الهيدروكسيل OH- أو الراديكالي Cl-. ومع ذلك ، فهي تُعرف بالمجموعات الوظيفية عندما تكون ذرات أو مجموعات ذرات مرتبطة بسلسلة ثاني أكسيد الكربون (بكربون مختلف) والمسؤول عن تفاعل وخواص المواد الكيميائية الجزيئات.
هذه المجموعات مهمة بشكل خاص في الكيمياء العضوية (الجزيئات الحيوية البشرية هي أساسًا الكربون والهيدروجين). بعض الأمثلة على المجموعات الوظيفية هي مجموعة الكربونيل = C = O أو مجموعة الكربوكسيل -COOH.

الصورة: Monogramas.com
كما قلنا، هناك عدة أنواع من الصيغ الكيميائية. تعطينا كل من هذه الصيغ نوعًا مختلفًا من المعلومات حول الجزيئات ، وبالتالي ، إنه يخدم هدفًا معينًا ، دون أن تكون أي صيغة أفضل أو أسوأ من غيرها بشكل عام.
فئات الصيغ الكيميائية التي نميزها هي:
الصيغ التجريبية
الصيغ التجريبية هي أبسط الصيغ لتمثيل جزيء كيميائي ، وتقول أحيانًا إنها أقل الصيغ. تمثل هذه الصيغ نسبة ذرات كل عنصر في الجزيء ، والتي يتم تبسيطها إلى أعداد صحيحة ، دائمًا الأصغر. مثال على هذه الصيغة هو CH3 (مجموعة الميثيل) ، مع ثلاث ذرات هيدروجين وذرة كربون واحدة.
ومع ذلك ، يمكن أن تعطي هذه الصيغ أحيانًا مفاهيم خاطئة حول تكوين الجزيء. يحدث هذا عندما لا تشير الصيغة إلى العدد الفعلي للذرات في الجزيء ، كما هو الحال مع البيروكسيد الهيدروجين ، الذي تكون صيغته التجريبية H O عندما تكون الصيغة H2O2 (ذرتان من الهيدروجين واثنتان من الأكسجين). وهكذا يحدث هذا من خلال اصطلاح التسمية ، نظرًا لأن كلا الخطين متساويين ، يتم تبسيطهما.
ومع ذلك ، لا يمكن تمثيل بعض المركبات إلا من خلال الصيغ التجريبية ، لأنها تتكون من شبكات أيونية. يحدث هذا على سبيل المثال في الملح الشائع أو كلوريد الصوديوم ، والذي يتم تمثيله كـ NaCl ، مما يشير إلى وجود كلور لكل صوديوم.
الصيغ الجزيئية
هذه الأنواع من الصيغ أساسية تمامًا ، فهي تعبر ببساطة عن نوع الذرات وعدد كل حاضر في الجزيء التساهمي. إنها الصيغ التي تعرض العناصر الكيميائية والرقم بطريقة خطية (في شكل خط منخفض. مثال على هذا النوع من الصيغة هو عندما يسمى الجلوكوز C6H12O6 ، والذي يعبر عن هذا الجلوكوز يتكون جزيء الجلوكوز من ست ذرات كربون و 12 ذرة هيدروجين وستة من الأكسجين.
تستخدم الصيغ الجزيئية على نطاق واسع ، وتقول أحيانًا إنها الصيغ الحقيقية للجزيئات. في كثير من الحالات ، تتطابق مع الصيغ التجريبية ، على سبيل المثال في CO2.
الصيغ شبه المطورة
الصيغ شبه المطورة هي نوع من الصيغ المشابهة للصيغ الجزيئية ، لأنها تعبر أيضًا عن الذرات التي يتكون منها الجزيء وعددها ، ولكن أيضًا قدم معلومات عن الروابط الكيميائية (ممثلة بالخطوط بين الذرات) ونوع الرابطة بين ذرات الكربون التي تشكلها (إذا كانت بسيطة أو مزدوجة أو ثلاث مرات). الصيغة شبه المطورة مفيدة في تحديد الجذور التي يتكون منها الجزيء وبنيته الكيميائية (الروابط بين ذرات الكربون والهيدروجين غير ممثلة).
في حالة الجلوكوز ، فإن صيغته شبه المطورة هي CH2OH - CHOH - CHOH - CHOH -CHOH - CHO وكما يمكن أن نرى ذرات الكربون والهيدروجين و الأكسجين هو نفسه الموجود في الصيغة الجزيئية (ستة ، واثني عشر ، وستة ، على التوالي) وجميع الروابط الفردية (الجلوكوز له روابط فقط بسيط). وبالتالي فإن هذه الصيغة هي صيغة أكثر تعقيدًا من الصيغة الجزيئية.
تسمى الصيغ شبه المطورة أحيانًا بالمكثفة وربما تكون أكثر فئات الصيغ استخدامًا. تستخدم ، خاصة في الكيمياء العضوية ، على الرغم من أنها لا تسمح لنا بمراقبة الهندسة الحقيقية للجزيئات.
صيغة مطورة
الصيغ المطورة أكثر تعقيدًا قليلاً من الصيغ شبه المطورة. في هذا النوع من الصيغ ، يتم تمثيل الرابطة وموقع كل ذرة في الجزيء في المستوى الديكارتي ، حتى يتم تمثيل المركب بأكمله.
الصيغة الهيكلية
الصيغة الهيكلية هي تمثيل رسومي لهيكل الجزيء في الفضاء ، مما يمنحنا معلومات حول ترتيب وتوزيع الذرات في الفضاء. في هذه الصيغة ، يتم أيضًا عرض الروابط الكيميائية التي يتكون منها الجزيء وإذا كانت مفردة أو مزدوجة أو ثلاثية. وبالتالي ، فإن هذه الصيغة هي التي تعطينا أكبر قدر من المعلومات عن الجزيء.
تُستخدم هذه الأنواع من الصيغ بشكل أكبر على المستوى المهني في عالم الكيمياء ، لأنها تسمح برؤية التفاعلات الكيميائية أو تخليق الجزيئات الجديدة بشكل أكثر وضوحًا.
صيغ لويس
هذه صيغ معقدة ومحددة للغاية وتقنية. تُعرف أيضًا باسم مخططات لويس أو هياكلها وتشبه الصيغ المطورة للجزيئات ، ولكن بالإضافة إلى ذلك ، يشار إلى الإلكترونات التي تشترك فيها الذرات في كل رابطة كيميائية ، والتي تختلف باختلاف تكافؤ الذرات متضمن.
في هذه الصيغ ، يتم تمثيل الروابط بين الذرات بخطوط (تشير أيضًا إلى ما إذا كانت مفردة أو مزدوجة أو ثلاثية) أو بزوج من النقاط. يتم تمثيل الإلكترونات أو الإلكترونات المنفردة غير المشتركة في الرابطة بنقاط حول الذرة التي تتوافق معها.

الصورة: الكيمياء العضوية
عند كتابة الصيغ ، تتم الإشارة أحيانًا إلى ملفعدد التأكسد العنصر (يتكرر في المركبات الأيونية). هذه مجموعة من الأرقام الموجبة والسالبة المرتبطة بكل عنصر.
- يمكن تفسير أرقام الأكسدة على أنها عدد الإلكترونات أن عنصرًا يشارك في سند تساهمي أو ينتقل في سند أيوني.
- عندما تكون علامة الأكسدة فوق الذرة نفي، يعني أن هذا العنصر يلتقط الإلكترونات والرقم المصاحب له بجانبه هو عدد الإلكترونات الملتقطة. لذلك ، تعني حالة الأكسدة -1 أن العنصر يلتقط إلكترونًا واحدًا ، و -2 يلتقط إلكترونين ، وهكذا.
- عندما تكون علامة الأكسدة إيجابي، تتخلى الذرة عن إلكترون والرقم المصاحب لهذه العلامة هو عدد الإلكترونات التي تم التخلي عنها. وبالمثل ، تعني حالة الأكسدة +1 أنها تنتج إلكترونًا واحدًا ، +2 أنها تنتج إلكترونين ، وهكذا.
هذا يعمل في الغالب ل المركبات الأيونية، في الروابط التساهمية ، على الرغم من أن التفسير مشابه ، إلا أنه ليس هو نفسه لأن هذه الروابط تشترك في الإلكترونات. في هذه المركبات ، نتحدث عن المزيد من العناصر الكهربية ، التي تسحب المزيد من الزوج الإلكتروني وتترك شحنة سالبة أكثر ، اعتمادًا على عدد الإلكترونات التي تجذبها. يمكن ملاحظة ذلك في ملف صيغ لويس.
إذا كنت تريد معرفة الصيغ الكيميائية المستخدمة ، فعليك أن تأخذ في الاعتبار أن هذا الرقم يسمح لنا بالحصول على البعض معلومات الجزيء، كما هم:
- ال فئة الارتباط التي تتشكل بين ذرات الجزيء أو المركب. عادة ما تكون هذه الروابط تساهمية عندما تشارك فيها الذرات غير المعدنية والأيونية إذا كانت روابط معدنية وغير معدنية.
- ال الكتلة الجزيئية للجزيء.
- ال عدد الذرات من كل عنصر يتكون من الجزيء. يطلق عليه أحيانًا التركيب المئوي للجزيء.
- أعرب عن الكتلة في جرامات التي من شأنها أن تحتوي على مول واحد من هذا الجزيء.
في حالة وجود مركب أيوني ، على سبيل المثال كلوريد الصوديوم أو الملح الشائع ، فإنه ليس صحيحًا تمامًا نتحدث عن الجزيئات (على الرغم من أنه يتم ذلك في بعض الأحيان) ، فإنها تميل إلى تكوين تجمعات كبيرة و الجزيئات الكبيرة. في هذه الحالة ، تساعدنا صيغة المركب في معرفة الأيونات التي يتكون منها وبأي كمية.



