Découvrez où sont les électrons dans un ATOM

Les électrons sont des particules subatomiques qui tournent autour du noyau atomique dans un nuage d'électrons appelé cortex électronique. Dans cette leçon d'un ENSEIGNANT, nous verrons où sont les électrons au sein de la structure atomique, ainsi que le comportement des électrons dans les différents états des atomes (état fondamental et d'excitation), lorsque les atomes forment ions monoatomiques et lorsque les électrons ne sont liés à aucun atome particulier.
Indice
- Que sont les électrons et où se trouvent-ils ?
- Comment savez-vous ce que sont les électrons de valence ?
- Électrons d'un atome: état fondamental et en état d'excitation
- Gain ou perte d'électrons: formation d'ions monoatomiques
- Électrons en mouvement: courant électrique
Que sont les électrons et où se trouvent-ils?
Les électrons je connais trouver à l'intérieur des atomesqui sont les plus petites unités qui composent la matière. Les atomes sont indivisibles et leur structure et leur composition déterminent les caractéristiques des matériaux.
Les atomes sont constitués de trois types de particules subatomiques:
- Protons : sont des particules de masse et de charge positive
- Neutrons: sont des particules avec une masse et sans charge électrique
- Électrons: Ce sont des particules sans masse et chargées négativement.
Les protons et les neutrons font partie du noyau de l'atome, de sorte que le noyau atomique il concentre toute la masse et la charge positive de l'atome.
Les électrons, quant à eux, tournent autour du noyau sur des orbites définies, formant un nuage d'électrons appelé cortex électronique. La coquille électronique de l'atome concentre toute la charge négative et n'a pas de masse.
Orbites d'électrons
Les orbites que les électrons décrivent autour du noyau atomique sont certaines orbites prédéfinies. C'est-à-dire que les chemins des électrons autour du noyau atomique ne sont pas aléatoires. Dans la couche électronique, il n'y a que quelques orbites possibles pour les électrons; tandis que les autres orbites sont interdites. est défini comme orbitale atomique cette zone autour du noyau dans laquelle la probabilité de trouver un électron est supérieure à 90 %.
Dans chacune de ces orbitales possibles, l'électron qui y circule acquiert une certaine énergie qui augmente à mesure que les orbitales s'éloignent du noyau. Les orbitales sont regroupées en différentes niveaux d'énergie (n) ou couches, il existe au total 7 niveaux d'énergie, n = 1 étant le niveau d'énergie le plus bas et le plus proche du noyau de l'atome. Dans chacun des niveaux ou couches d'énergie, il existe différents types d'orbitales (orbitales s, p, d et f)
L'arrangement dans lequel les électrons sont distribués dans les différents niveaux d'énergie et orbitales dans un atome est connu sous le nom configuration électronique.
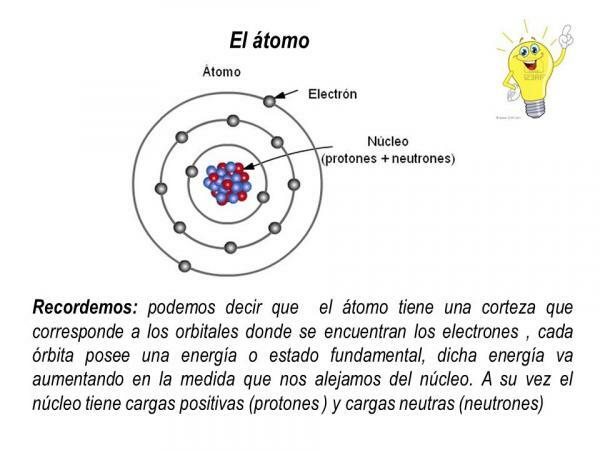
Image: Lecteur de diapositives
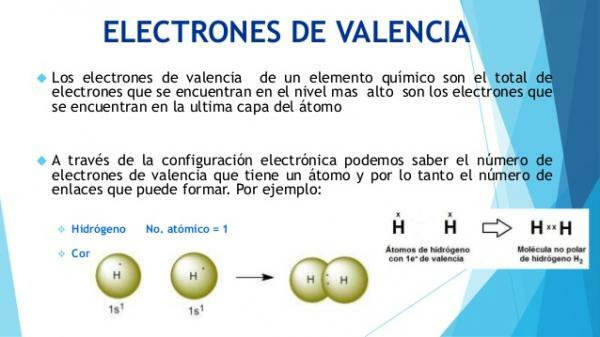
Comment savez-vous ce que sont les électrons de valence?
Les caractéristiques physiques et chimiques des atomes sont définies par leur composition et, surtout, par la configuration électronique de leur couche la plus externe (couche de valence).
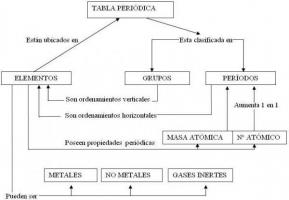
Les éléments chimiques sont les différents types d'atomes qui existent et sont définis par leur numéro atomique (Z) et leur nombre de masse (A).
- Numéro atomique (Z): nombre de protons d'un élément atomique, qui est égal au nombre d'électrons si l'atome est neutre.
- Numéro de masse (A): nombre de particules avec la masse d'un élément atomique, c'est-à-dire la somme des particules du noyau atomique (protons plus neutrons).
Chaque élément se voit attribuer un symbole chimique qui le représente et l'ensemble de tous est consigné dans le document scientifique que le rangs selon leur numéro atomique et les regroupe selon leurs caractéristiques en familles et groupes d'affines: Table périodique.
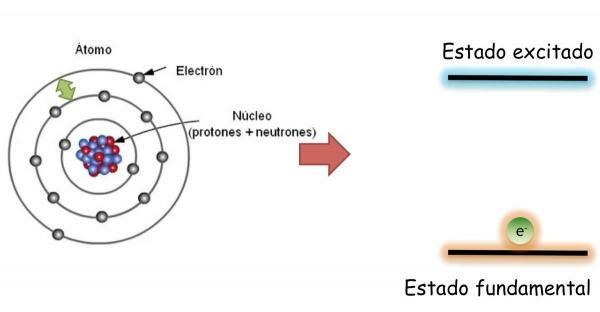
Électrons d'un atome: état fondamental et en état d'excitation.
Dans le état fondamental, qui est défini comme l'état d'énergie minimale et de stabilité maximale d'un atome; les électrons ne sont pas répartis aléatoirement dans les différentes orbitales atomiques, mais occupent les différentes orbitales de manière ordonnée, en remplissant toujours en premier lieu, les orbitales sans énergie la plus basse.
Dans cet état, l'atome a le même nombre d'électrons que les protons et les charges positives et négatives se compensent, donc l'atome dans son ensemble est neutre (il n'a pas de charge nette).
Cependant, les électrons peut sauter d'une orbitale à une autre dégageant ou absorbant de l'énergie. Lorsque les électrons d'un atome ne remplissent pas les orbitales de manière ordonnée, on dit que l'atome est en état excité. Dans l'état d'excitation, un ou plusieurs électrons occupent des orbitales d'énergie plus élevée laissant vides d'autres d'énergie plus faible. A l'état excité, les atomes sont très instables et ont tendance à revenir rapidement à l'état fondamental.
Lors du changement d'orbite l'électron émet ou absorbe de l'énergie. Si l'électron saute d'une orbite d'énergie inférieure à une orbite d'énergie supérieure, l'atome absorbera de l'énergie; tandis que si le saut est fait dans la direction opposée (d'une orbitale d'énergie supérieure à une d'énergie inférieure), l'atome libérera de l'énergie.
Perte ou gain d'électrons: formation d'ions monoatomiques.
Les électrons de la couche la plus externe du cortex électronique (appelée couche de valence) sont des électrons qui ils peuvent quitter l'atome ou ils peuvent être incorporés cette. De cette façon, un atome peut gagner ou perdre des électrons.
En un atome neutre le nombre de protons présents dans le noyau est égal à celui des électrons qui composent sa couche électronique. C'est-à-dire que le nombre de charges positives est égal au nombre de charges négatives. Lorsqu'il y a gain ou perte d'électrons, les atomes forment ions monoatomiques.
Types d'ions monoatomiques
Selon la charge de l'ion, on distingue deux types :
- Cations monoatomiques : atomes qui ont perdu un ou plusieurs électrons, de sorte qu'une partie de la charge positive du noyau n'est pas compensée. Par conséquent, l'atome acquiert une charge positive nette.
- Anions monoatomiques: atomes qui ont gagné un ou plusieurs électrons de sorte que le nombre d'électrons est supérieur au nombre de protons dans le noyau de sorte que l'atome acquiert une charge négative nette.

Électrons en mouvement: courant électrique.
Quand les électrons ils ne sont liés à aucun atome en particulier, ils se déplacent dans l'espace libre entre les atomes. Ce mouvement indépendant des électrons forme un flux de charge électrique qui peut traverser certains matériaux (matériaux conducteurs et semi-conducteurs).
C'est par exemple ce qui se passe dans le cas de courant électrique qui alimente les bâtiments, les véhicules, etc.
Si vous voulez lire plus d'articles similaires à Où trouve-t-on les électrons ?, nous vous recommandons d'entrer dans notre catégorie de L'atome.
Bibliographie
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Chimie de base. Madrid: Uned