SVA svojstva ATOMA

Slika: SlideShare
Iako ih nismo u mogućnosti vidjeti golim okom, atomi su dio sve tvari našeg planeta. Sva je materija sačinjena od atoma, koji se grupiraju u kemijske elemente, molekule, spojeve itd. Atom je definiran kao najmanja osnovna jedinica materije koja ima svojstva kemijskog elementa. Svaki kemijski element definiran je vrstom atoma od kojeg je stvoren, pa je konačno pitanje: kakva svojstva ima atom? U ovoj lekciji od UČITELJA pregledat ćemo svojstva atoma koji svaki atom čine karakterističnim za kemijski element.
Indeks
- Što je atom?
- Atomski broj, maseni broj i izotopi
- Gustoća, još jedno od svojstava atoma
- Jonski radijus i radijus Vanderwalla
- Energija jonizacije
Što je atom?
Prije ulaska u analizu svojstava atoma važno je da bolje znamo o čemu se radi. The atom je jedinica koju čine tri subatomske čestice: protoni, neutroni i elektroni. Oni su organizirani u jezgri i kori.
- The jezgra Izmišljeno je protoni Y neutronima, koji je u središtu atoma i odgovoran je za većinu težine atoma; protoni su pozitivno nabijeni, dok su neutroni neutralni pa je jezgra pozitivno nabijena.
- The Korteks Tvori ga elektroni, koje su male, negativno nabijene čestice koje se okreću oko jezgre tvoreći orbite (poput one planeta), ali bez da ikad padnu u jezgru atoma. Korteks atoma odgovoran je za interakciju s korom ostalih atoma jer se nalazi na vanjskoj strani atoma.
Različiti atomi sastoje se od protona, neutrona i elektrona, jednaki u svim kemijskim elementima. Pa što čini različite kemijske elemente? Broj protona, neutrona i elektrona od kojih su atomi svakog elementa različiti i to zauzvrat čini svaki element drugačijim značajke ili drugi.

Slika: SlideShare
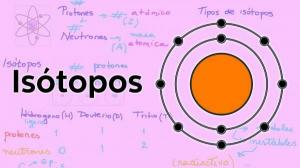
Atomski broj, maseni broj i izotopi.
Prve tri karakteristike povezane su izravno s brojem čestica koje čine atom svakog elementa.
The atomski broj (Z) označava broj protona koji čine jezgru atoma. Tako će, na primjer, svi atomi željeza u svojoj jezgri imati 26 protona. Osim toga, ako nam ne kažu drugačije, kemijski elementi su u neutralnom stanju, tj pozitivan (protoni) i negativni (elektroni) naboj je isti, pa će svi oni također imati 26 elektroni.
The maseni broj ili atomska težina (A) označava ukupan broj protona i neutrona koji čine jezgru atoma. Kao što smo već ranije naznačili, težina elektrona je praktički zanemariva u usporedbi s težinom elektrona. protona i neutrona, pa maseni broj neizravno ukazuje na težinu dotičnog atoma. Nastavljajući s primjerom željeza, ako pogledate periodni sustav elemenata, vidjet ćete da je težina atomski ovog elementa je 55,85, što znači da će to imati svi atomi tog elementa težina.
Napokon, izotopi kemijskog elementa su inačice istog atoma (tj. imaju isti atomski broj), ali različit maseni broj, odnosno različit broj neutrona. Većina kemijskih elemenata ima više od jednog prirodnog izotopa, element s najvećom količinom stabilnih izotopa je kositar (Sn) koji ima 10 različitih prirodnih izotopa.

Slika: ConceptDefinition.de
Gustoća, još jedno od svojstava atoma.
The gustoća atoma je broj jedinica mase (u.m.a) elementa koji su prisutni u određenom volumenu prostora. Gustoća bilo koje tvari simbolizirana je grčkim slovom "Ro" (napisano r) a njegove jedinice prema međunarodnom sustavu jedinica (SI) su kilogrami po kubičnom metru (kg / m3). U slučaju da su kemijski elementi tako mali, gram po kubičnom centimetru (g / cm3).
Da bi izračunati gustoću atoma (atomska gustoća), morali bismo uzeti u obzir masu atoma i njegov volumen. Iako je većina mase atoma u jezgri istog, volumen mora biti učinjen s tim koliko je velik atom, i stoga će broj elektroničkih orbitala igrati ulogu važno. Uzimajući u obzir ta svojstva i njihovu tendenciju u periodičnom sustavu, možemo primijetiti da gustoća raste kako se povećavamo u skupini, a također se povećava kako se približavamo središnjem dijelu od periodni sustav elemenata.

Slika: YouTube
Jonski radijus i radijus Vanderwalla.
The ionski radijus je radijus koji ion elementa ima u ionskom kristalnom stanju. U tom su stanju ioni toliko blizu jedan drugome da su najudaljenije elektroničke orbitale u međusobnom kontaktu.
S druge strane, radijus vanderwallova je udaljenost između dva atoma razdvojena zbog odbijanja negativnih naboja između elektrona svakog od atoma. Polumjer Vanderwalla bio bi polumjer zamišljene čvrste kugle koja se koristi za modeliranje atoma, pa se ne koristi puno u svakodnevnoj praksi.
Za razliku od onoga što se događa s gustoćom ili masom, ta su dva svojstva usko povezana s volumenom atoma, to jest imaju više veze s brojem elektrona u njemu nego s jezgra.

Slika: SlidePlayer
Energija jonizacije.
Konačno, još jedno od svojstava atoma je energija ionizacije, svojstvo koje nam govori o energiji koja nam je potrebna za odvajanje elektrona u osnovnom stanju (osim aniona ili kationa) atoma elementa u plinovitom stanju, ali se također može definirati kao sila kojom se elektron veže s drugim molekule. Ova je nekretnina vrlo zanimljiva jer nam omogućuje da okvirno shvatimo sposobnost reagiranja atoma određenog kemijskog elementa. Energija ionizacije je veća kad uklanjamo elektrone, pa za element postoji energija prva ionizacija, druga energija ionizacije, i tako dalje i oni postaju sve veći i veći.
Kao i u prethodnom slučaju, ovo je svojstvo također usko povezano s brojem orbitala predmetni element jer, što ima manje orbitala, to će više koštati uklanjanje elektrona iz atoma odlučan.

Slika: SlidePlayer
Ako želite pročitati više članaka sličnih Svojstva atoma, preporučujemo da uđete u našu kategoriju Atom.