Razlika između endotermnih i egzotermnih reakcija
A endotermna reakcija zahtijeva snagu dok a egzotermna reakcija oslobađa energiju. Ova klasifikacija kemijskih reakcija uzima u obzir sudjelovanje energije bilo kao reaktant ili kao proizvod.
Energija je sposobnost obavljanja posla ili proizvodnje topline. Imajte na umu da kemijske reakcije uključuju reorganizaciju atoma između tvari s pucanjem ili stvaranjem kemijskih veza. Općenito, ovo stvaranje ili prekid kemijskih veza popraćeno je promjenama u energiji sustava.
| Endotermna reakcija | Egzotermna reakcija | |
|---|---|---|
| Definicija | Kemijska reakcija gdje se apsorbira energija. | Kemijska reakcija gdje se energija oslobađa u obliku topline. |
| Podrijetlo energije | Od okoline | Sustava |
| Potencijalna energija | Niže u reaktantima nego u proizvodima. | Više u reaktantima nego u proizvodima. |
| Proizvodnja | Nije spontano | Spontano |
| Unutarnja promjena energije | ΔE> 0; unutarnja promjena energije veća od nule. | ΔE <0; unutarnja promjena energije manja od nule. |
| Temperatura | Smanjuje se | Povećava |
| Primjeri | Reakcije u fotosintezi i sinteza općenito. | Goruća šibica, reakcije izgaranja. |
Što je endotermna reakcija?
Kemijska reakcija je endotermna kada upija energiju iz okoline. U tom se slučaju toplina prenosi izvana u unutrašnjost sustava. Kad postavimo termometar dok se odvija endotermna reakcija, temperatura pada.
Riječ "endotermno" potječe od grčkog endon što znači "iznutra" i terme što znači "toplina". Endotermne reakcije se ne odvijaju spontano.
Odakle energija u endotermnim reakcijama?
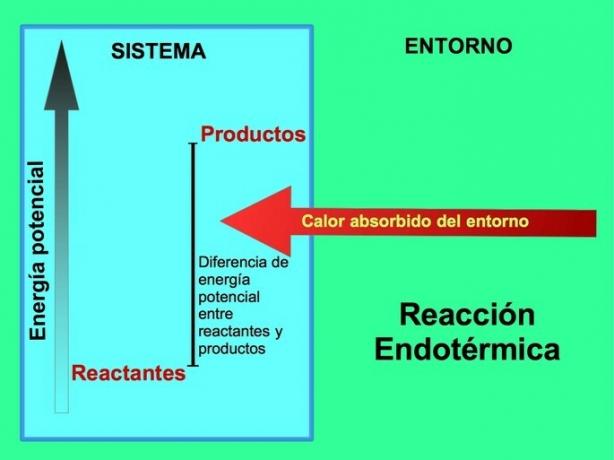
U endotermnim reakcijama energija dolazi iz okoline izvan sustava. Količina potencijalne energije proizvoda veća je od potencijalne energije reaktanata. Zbog toga je potrebno dodati reaktantima energiju za nastavak reakcije. Ova energija dolazi iz topline okoliša.
Na primjer, fotosinteza je endotermni proces, gdje biljke hvataju sunčevu energiju za proizvodnju glukoze iz ugljičnog dioksida i kisika:

Produkti reakcije fotosinteze, glukoza i kisik, imaju veću količinu potencijalne energije u odnosu na reaktante, ugljični dioksid i vodu. Ostali primjeri endotermnih kemijskih reakcija s utrošenom količinom energije:

Primjeri endotermne reakcije
Reakcije se ne događaju samo u kemijskom laboratoriju. Svakodnevno pronalazimo i situacije u kojima se javljaju endotermne reakcije.
Kuhanje hrane
Iako se možda ne čini tako, postupak kuhanja hrane je endotermičan. Da bismo konzumirali određenu hranu, moramo osigurati toplinu.
Instant hladna vrećica
Hladna pakiranja koja se koriste za liječenje kvrga ili uganuća pune se vodom, ali kad se protresu ili kucaju, kapsula koja sadrži amonijev nitrat probija se unutra. Miješanje amonijevog nitrata s vodom endotermna je reakcija zbog koje se vrećica hladi.
Možda će vas zanimati Razlika između topline i temperature.
Što je egzotermna reakcija?
A egzotermna reakcija je ona u kojoj energija istječe iz sustava. Ova se energija oslobađa u obliku topline, pa postavljanje termometra u reakcijski sustav povećava temperaturu.
Riječ "egzotermno" tvori egzo što znači "prema van" i terme, što znači "toplina". Egzotermne reakcije mogu se pojaviti spontano i, u nekim slučajevima, mogu biti eksplozivne, poput kombinacije alkalnih metala i vode.
Odakle dolazi energija u egzotermnim reakcijama?
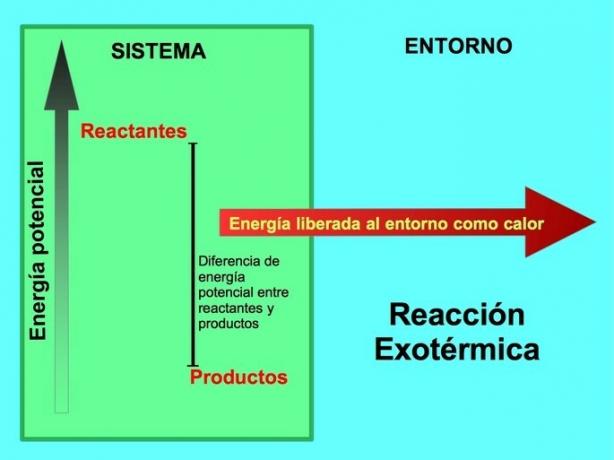
U kemijskoj reakciji reaktanti su spojevi koji se transformiraju i daju produkte. Na primjer, kada natrij Na reagira s klorom Cl, to su reaktanti, a produkt je natrij klorid NaCl:

I reaktanti i proizvodi pohranjuju potencijalnu energiju. Znamo iz lušteda energije ey ta se energija niti gubi niti dobiva, pa energija reaktanata mora biti jednaka energiji proizvoda.
U egzotermnoj reakciji lreaktanti imaju više potencijalne energije u usporedbi s proizvodima, pa se višak energije oslobađa kao toplina. U ovom se slučaju energija također smatra dijelom proizvoda:

U bilo kojem egzotermnom procesu, dio potencijalne energije pohranjene u kemijskim vezama pretvara se u toplinsku energiju toplinom.
Primjeri egzotermne reakcije
Deterdžent za pranje rublja
Kad u rukama otopimo malo praška za pranje s vodom, osjetimo lagano zagrijavanje.
Domaće izgaranje plina
Izgaranje plinova za domaću upotrebu, poput metana ili butana, uključuje kemijsku reakciju s kisikom s stvaranjem ugljičnog dioksida i vode te oslobađanje energije. Ovo je tipična egzotermna reakcija u svakodnevnoj upotrebi:
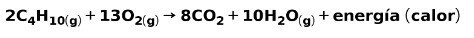
Energija koja se oslobađa u procesu izgaranja koristi se za kuhanje hrane.
Možda će vas također zanimati što su Otvoreni sustav, zatvoreni sustav i izolirani sustav.


