10 vrsta kemijskih elemenata (objašnjeno i klasificirano)
Koliko kemijskih elemenata mora postojati u svemiru? Ovo pitanje još ima dug put budući da znanstvenici s vremena na vrijeme stvaraju vlastite umjetne kemijske elemente.
Međutim, ono na što možemo odgovoriti jest koliko vrsta kemijskih elemenata mora postojati, nešto što ćemo sljedeće saznati.
- Vezani članak: "11 vrsta kemijskih reakcija"
Vrste kemijskih elemenata
U prirodi možemo pronaći sve vrste tvari. Ove tvari se obično ne nalaze u čistom stanju, već su rezultat kombinacije različitih elemenata ili materijala koji su različitim reakcijama, procesima i vremenskim razdobljima doveli do nastanka svih vrsta materija. Ne postoji ništa u svemiru što nije rezultat kombinacije atoma koji pripadaju različitim vrstama kemijskih elemenata, što ćemo dubinski vidjeti.
No, prije nego što pogledamo vrste kemijskih elemenata, napravimo mali pregled srednjoškolskih znanosti i sjetimo se što su kemijski elementi.
"Kemijskim elementom" nazivamo materiju koja se sastoji od iste vrste atoma, odnosno tvari koja je atomski čista.
Kemijski elementi ne mogu se razgraditi na jednostavnije i klasificirani su u periodnom sustavu elemenata kao čistih materijala svemira.Ali oprez! Ne smijemo miješati elemente s jednostavnim tvarima, jer se u određenim slučajevima mogu sastojati dva ili više atoma istog elementa molekule grupirane na različite načine zbog kojih se mijenjaju neka fizička svojstva dotičnog elementa, a ti su slučajevi izotopa. Na primjer, dijamant i ugljik su tvari napravljene od kemijskog elementa ugljika (C). ali to je organizirano na različite načine i rezultira u dva potpuno različita materijala.
Carl sagan Rečeno je da smo zvjezdana prašina koja se reflektira na zvijezde. Ova lijepa fraza nije puka metafora, već znanstvena činjenica. Koliko znamo, kemijski elementi nastaju unutar zvijezda kao rezultat kompleksa fuzijski i atomski fisijski procesi koji stvaraju sve teže elemente, rezultat procesa tzv nukleosinteza.
Većina poznatih elemenata može se dobiti iz prirode, pronađeni spontano ili tvoreći spojeve s drugim elementima kao što su uran (U), ugljik (C), silicij (Si), srebro (Ag) ili zlato (Au). Drugi su, s druge strane, proizvedeni u laboratorijima poput americija (Am), berkelija (Bk) ili kurija (Cm). Bez obzira na način na koji ga dobivaju ili ako je prisutan u prirodi, ovisno o njegovim svojstvima, dotični će kemijski element imati neku ili drugu uporabu.
Trenutno je poznato oko 118 kemijskih elemenata, iako je uzevši u obzir da su ljudi uspjeli proizvesti nove elemente, samo je pitanje vremena kada će se periodni sustav proširiti.
- Možda će vas zanimati: "2 vrste električne energije (objašnjeno)"
Glavne vrste kemijskih elemenata
Glavne vrste kemijskih elemenata predstavljene su u periodnom sustavu, sustavu klasifikaciju koju je stvorio ruski kemičar Dmitri Mendeleev (1834-1907) koji je postavio temelje u 1869. Kemijski elementi vizualno su raspoređeni na temelju njihovih svojstava i karakteristika.
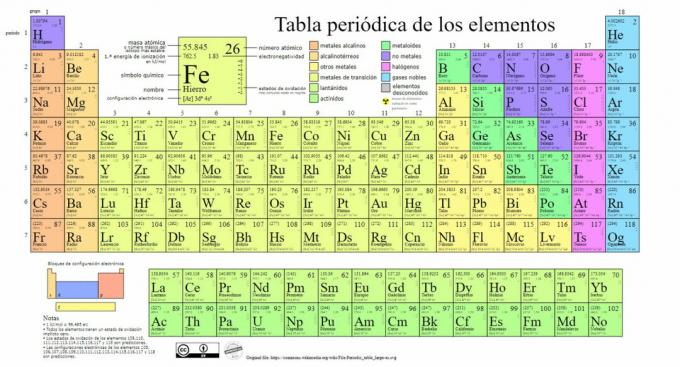
S vremenom i kako je kemija donijela važna znanstvena otkrića, ova bi se tablica uzastopno proširivala, dosegnuvši oblik koji danas ima sa dosad poznatih 118 elemenata.
Trenutno u ovoj tablici možemo pronaći sljedeće vrste kemijskih elemenata:
1. Metali
Metali su kemijski elementi koji općenito sadrže između jednog i tri elektrona u zadnjoj orbiti svog atoma, elektroni koji se mogu lako prenijeti čineći ih vodičima topline i električne energije.
Metali su obično savitljivi i duktilni, karakterističnog sjaja čiji intenzitet ovisi o kretanju elektrona koji čine njihove atome. Većinu vremena metali su čvrsti na sobnoj temperaturi, osim žive.
Među metalima nalazimo zlato (Au), srebro (Ag), bakar (Cu) i aluminij (Al) čije fizičke karakteristike ih čine veličanstvenim vodičima električne energije, iako je njihova prisutnost u prirodi vrlo raznolika, što se odražava u razlici između njihovih težina.
Vjeruje se da 75% kemijskih elemenata koji postoje u prirodi čine metali, dok bi preostalih 25% činili plemeniti plinovi, metaloidi i druge vrste.
Unutar ove kategorije postoje klasifikacije prema kojima se nalaze aktinidi, lantanidi, prijelazni metali, alkalni metali, zemnoalkalijski metali i drugi metali.
- Vezani članak: "10 namirnica bogatih cinkom"
1.1. Lantanidi
Elementi lantanida nalaze se u naslagama sastavljenim od mnogih minerala. Oni su bijeli metali koji lako oksidiraju u dodiru sa zrakom. Među njima nalazimo lantan (La), prometij (Pm), europij (Eu) i iterbij (Yb).

- Možda će vas zanimati: "5 vrsta kemijskih veza: ovako je sastavljena materija"
1.2. Actinidi
Svi izotopi aktinida su radioaktivni. Među njima nalazimo aktinij (Ac), uran (U), plutonij (Pu) i einsteinij (Es).
1.3. Prijelazni metali
Prijelazni metali nalaze se u središnjem dijelu periodnog sustava. Njegova glavna karakteristika je ta imaju elektroničku konfiguraciju "d" orbite djelomično ispunjenu elektronima.
U ovoj skupini postoje tvari svih vrsta i prema najširoj klasifikaciji odgovarale bi kemijskim elementima od 21 do 30, od 39 do 48, od 71 do 80 i od 103 do 112, ukupno četrdeset, a među njima bismo našli vanadij (V), rutenij (Ru), srebro (Ag), tantal (Ta) i lawrencio (Lr).

1.4. Alkalni metali
Alkalni metali skupina je od šest elemenata sastavljenih od litija (Li), natrija (Na), kalija (K), rubidija (Rb), cezija (Cs) i francija (Fr). Oni su sjajni, meki metali, vrlo reaktivni pri normalnoj temperaturi i tlaku i lako gube vanjski elektron, koji se nalazi u njihovoj "s" orbiti.
1.5. Alkalne zemlje
Zemnoalkalijski metali skupina je elemenata u kojima nalazimo berilij (Be), magnezij (Mg), kalcij (Ca), stroncij (Sr), barij (Ba) i radij (Ra). Njegovo ime potječe od naziva oksida, "zemlje", koji imaju osnovna ili alkalna svojstva.
Alkalne zemlje tvrđi su od lužnatih, sjaje i dobri su električni vodiči. Oni su manje reaktivni od alkalnih i djeluju kao dobri redukcijski agensi. Imaju sposobnost stvaranja ionskih spojeva i svi imaju dva elektrona u svojoj najudaljenijoj ljusci.

1.6. Ostali metali
Kategorija "ostali metali" je vrsta tvari koje se ovdje nalaze jer zapravo ne znate gdje ih staviti.
Oni su metalni elementi koji se nalaze u periodnom sustavu zajedno s metaloidima, unutar p bloka. Skloni su biti mekani s niskim talištima. Među njima su aluminij (Al), indij (In), kositar (Sn) i bizmut (Bi).

2. Bez metala
Nemetali općenito imaju između pet i sedam elektrona u posljednjoj orbiti, što je svojstvo koje čini da dobivaju elektrone umjesto da ih se odreknu i na taj način uspijevaju imati osam elektrona koji ih na taj način stabiliziraju atomi.
Ovi elementi oni su vrlo loši vodiči topline i električne energije. Dodano tome, nemaju karakterističan sjaj, nisu jako podatne, nisu jako duktilne i vrlo su krhke u čvrstom stanju. Ne mogu se valjati ili rastezati, za razliku od metala.
Oni su uglavnom bitni za biološke sustave, budući da su prisutni u organski spojevi, poput sumpora (S), ugljika (C), kisika (O), vodika (H) i jod (I).

- Vezani članak: "20 vrsta dragog kamenja (opisano i sa slikama)"
3. Metaloidi
Kao što im ime govori, metaloidi su međurazvrstavanje između metala i nemetala koji imaju svojstva obje skupine. To je zbog činjenice da u posljednjoj orbiti imaju četiri atoma, što je srednja količina od one metala i nemetala.
Ti kemijski elementi provode električnu struju samo u jednom smjeru, ne dopuštajući da se ona odvija u suprotnom smjeru kao u metalima. Primjer toga nalazi se u siliciju (Si), metaloidu koji se koristi u proizvodnji poluvodičkih elemenata za elektroničku industriju zahvaljujući ovom svojstvu.
Ostali metaloidi su: bor (B), arsen (As), antimon (Sb) i polonij (Po).

4. Halogeni
Halogeni su skupina od šest elemenata koji skloni su tvoriti molekule sastavljene od dva atoma (dvoatomna) vrlo kemijski aktivne zbog svoje elektronegativnosti.
Te se tvari obično pojavljuju u obliku iona, odnosno električno nabijenih molekula, koje su u ovom slučaju mononegativne, jako oksidirajuće. To znači da su halogeni kaustične i korozivne tvari.
Halogeni su: fluor (F), klor (Cl), brom (Br), jod (I), astat (At) i tenes (Ts).

5. Plemeniti plinovi
Plemeniti plinovi skupina su od sedam čije je prirodno stanje plinovito. Obično se pojavljuju u obliku dvoatomnih molekula vrlo niske reaktivnosti, odnosno ne reagiraju s drugim elementima koji tvore druge tvari i iz istog su razloga poznati kao inertni plinovi. To je zato što u zadnjoj orbiti postoji najveći mogući broj elektrona za tu razinu, ukupno osam.
Ova odabrana skupina elemenata sastoji se od helija (He), neona (Ne), argona (Ar), kriptona (Kr), ksenona (Xe), radona (Rn) i oganesona (Og), ranije poznatog kao ununokcij.
