10 rūšių cheminių elementų (paaiškinta ir klasifikuojama)
Kiek cheminių elementų turi egzistuoti visatoje? Šis klausimas dar turi nueiti ilgą kelią, nes mokslininkai kartkartėmis kuria savo dirbtinius cheminius elementus.
Tačiau į ką galime atsakyti kiek rūšių cheminių elementų turi egzistuoti, ką mes išsiaiškinsime toliau.
- Susijęs straipsnis: „11 cheminių reakcijų rūšių“
Cheminių elementų rūšys
Gamtoje galime rasti visų rūšių medžiagų. Šios medžiagos paprastai nėra grynos būklės, bet yra skirtingų medžiagų derinio rezultatas elementai ar medžiagos, dėl kurių įvairios reakcijos, procesai ir laikotarpiai sukėlė visokių reikalas. Visatoje nėra nieko, kas nebūtų skirtingų tipų cheminių elementų atomų derinio rezultatas, kurį pamatysime nuodugniai.
Tačiau prieš žiūrėdami į cheminių elementų rūšis, šiek tiek apžvelkime vidurinės mokyklos mokslą ir prisiminkime, kas yra cheminiai elementai.
Mes vadiname „cheminiu elementu“ medžiagą, kurią sudaro to paties tipo atomas, tai yra medžiaga, kuri yra atomiškai gryna. Cheminių elementų negalima skaidyti į paprastesnius ir jie klasifikuojami periodinėje lentelėje elementų kaip grynos visatos medžiagos.
Bet saugokitės! neturėtume painioti elementų su paprastomis medžiagomis, nes tam tikrais atvejais gali sudaryti du ar daugiau to paties elemento atomų molekulės, sugrupuotos skirtingais būdais, dėl kurių skiriasi kai kurios aptariamo elemento fizinės savybės, šiais atvejais izotopai. Pavyzdžiui, deimantas ir anglis yra medžiagos, pagamintos iš cheminio elemento anglies (C). tačiau tai organizuojama įvairiais būdais ir gaunamos dvi visiškai skirtingos medžiagos.
Karlas saganas Jis sakė, kad mes esame žvaigždžių dulkės, atspindinčios žvaigždes. Ši graži frazė nėra tik metafora, bet mokslinis faktas. Cheminiai elementai, kiek mes žinome, žvaigždžių viduje susidaro dėl komplekso sintezės ir atominio skilimo procesai, kurie sukuria vis sunkesnius elementus, vadinamojo proceso rezultatas nukleosintezė.
Daugumą žinomų elementų galima gauti iš gamtos, randami spontaniškai arba sudarantys junginius su kitais elementais, tokiais kaip uranas (U), anglis (C), silicis (Si), sidabras (Ag) arba auksas (Au). Kita vertus, kiti buvo pagaminti laboratorijose, tokiose kaip americium (Am), berkelium (Bk) arba curium (Cm). Nepriklausomai nuo jo gavimo būdo ar gamtoje, atsižvelgiant į jo savybes, aptariamas cheminis elementas bus naudojamas tam tikrais atvejais.
Šiuo metu yra žinoma apie 118 cheminių elementų, nors, atsižvelgiant į tai, kad žmonės sugebėjo pagaminti naujų elementų, tik laiko klausimas, kada periodinė lentelė išsiplės.
- Jus gali sudominti: "2 elektros rūšys (paaiškinta)"
Pagrindinės cheminių elementų rūšys
Pagrindinės cheminių elementų rūšys yra pateiktos periodinėje lentelėje klasifikaciją sukūrė rusų chemikas Dmitrijus Mendelejevas (1834-1907), padėjęs pamatus 1869. Cheminiai elementai yra vizualiai išdėstyti pagal jų savybes ir savybes.
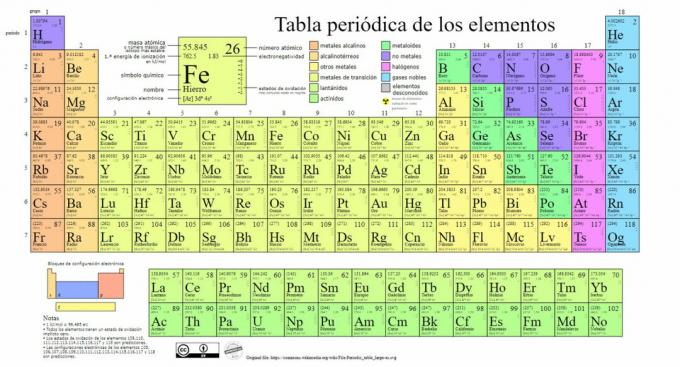
Laikui bėgant, kai chemija padarė svarbių mokslinių atradimų, ši lentelė bus nuosekliai plečiama, pasiekdamas tokią formą, kokią ji turi šiandien su 118 iki šiol žinomų elementų.
Šiuo metu šioje lentelėje galime rasti šių tipų cheminių elementų:
1. Metalai
Metalai yra cheminiai elementai, kurių paskutinėje atomo orbitoje paprastai yra nuo vieno iki trijų elektronų, kuriuos galima lengvai perkelti paversdami juos šilumos ir elektros laidininkais.
Metalai paprastai yra kalūs ir lankstūs, būdingo blizgesio, kurio intensyvumas priklauso nuo jų atomus sudarančių elektronų judėjimo. Dažniausiai metalai kambario temperatūroje yra kieti, išskyrus gyvsidabrį.
Tarp metalų randame auksą (Au), sidabrą (Ag), varį (Cu) ir aliuminį (Al), kurių fizinės savybės daro juos puikiais elektros laidininkais, nors jų buvimas gamtoje yra labai įvairus, atsispindi jų svorio skirtume.
Manoma, kad 75% gamtoje esančių cheminių elementų yra metalai, o likusius 25% sudarytų tauriosios dujos, metalloidai ir kitos rūšys.
Šioje kategorijoje yra klasifikacijų: randami aktinidai, lantanidai, pereinamieji metalai, šarminiai metalai, šarminių žemių metalai ir kiti metalai.
- Susijęs straipsnis: „10 maisto produktų, kuriuose yra daug cinko“
1.1. Lantanidai
Lantanido elementai randami nuosėdose, sudarytose iš daugelio mineralų. Tai balti metalai, kurie lengvai oksiduojasi, kai liečiasi su oru. Tarp jų randame lantano (La), prometžio (Pm), europio (Eu) ir itterbio (Yb).

- Jus gali sudominti: „5 cheminių jungčių tipai: taip sudaryta medžiaga“
1.2. Aktinidai
Visi aktinidų izotopai yra radioaktyvūs. Tarp jų randame aktiniumo (Ac), urano (U), plutonio (Pu) ir einšteino (Es).
1.3. Pereinamieji metalai
Pereinamieji metalai yra centrinėje periodinės sistemos dalyje. Jo pagrindinė savybė yra ta turi elektroninę „d“ orbitos konfigūraciją, iš dalies užpildytą elektronais.
Šioje grupėje yra visų rūšių medžiagų ir pagal plačiausią klasifikaciją ji atitiktų cheminius elementus nuo 21 iki 30, nuo 39 iki 48, nuo 71 iki 80 ir nuo 103 iki 112, iš viso keturiasdešimt ir tarp jų rasime vanadžio (V), rutenio (Ru), sidabro (Ag), tantalo (Ta) ir Lawrencio (Lr).

1.4. Šarminiai metalai
Šarminiai metalai yra šešių elementų grupė, susidedanti iš ličio (Li), natrio (Na), kalio (K), rubidžio (Rb), cezio (Cs) ir francio (Fr). Jie yra blizgūs, minkšti metalai, labai reaktyvūs esant normaliai temperatūrai ir slėgiui ir lengvai praranda išorinį elektroną, esantį „s“ orbitoje.
1.5. Šarminės žemės
Šarminių žemių metalai yra elementų grupė, kurioje randame berilio (Be), magnio (Mg), kalcio (Ca), stroncio (Sr), bario (Ba) ir radžio (Ra). Pavadinimas kilęs iš pavadinimo, kuris buvo suteiktas jo oksidams - „žemėms“, turinčioms bazines ar šarmines savybes.
Šarminės žemės jie yra kietesni už šarminius, blizga ir yra geri elektros laidininkai. Jie yra mažiau reaktyvūs nei šarminiai ir veikia kaip geri reduktoriai. Jie turi galimybę sudaryti joninius junginius ir jų visų išoriniame apvalkale yra du elektronai.

1.6. Kiti metalai
Kategorija „kiti metalai“ yra čia randamos tam tikros medžiagos, nes jūs tikrai nežinote, kur jas dėti.
Jie yra metaliniai elementai, esantys periodinėje lentelėje kartu su metalloidais, p bloke. Jie linkę būti minkšti, žemos lydymosi temperatūros. Tarp jų yra aliuminis (Al), indis (In), alavas (Sn) ir bismutas (Bi).

2. Nėra metalų
Nemetalai paprastai turi nuo penkių iki septynių elektronų paskutinėje orbitoje - tai savybė kad jie gauna elektronus, o ne atsisako jų, ir todėl jiems pavyksta turėti aštuonis elektronus, kurie taip juos stabilizuoja atomai.
Šie elementai jie yra labai prasti šilumos ir elektros laidininkai. Be to, jie neturi būdingo blizgesio, nėra labai kalingi, nėra labai lankstūs ir yra labai trapūs kietoje būsenoje. Priešingai nei metalai, jie negali būti valcuojami ar ištempiami.
Jie dažniausiai yra būtini biologinėms sistemoms, nes jų yra organiniai junginiai, tokie kaip siera (S), anglis (C), deguonis (O), vandenilis (H) ir jodas (I).

- Susijęs straipsnis: „20 brangiųjų akmenų rūšių (aprašytos ir su nuotraukomis)“
3. Metalloidai
Kaip rodo jų pavadinimas, metalloidai yra tarpinė klasifikacija tarp metalų ir nemetalų, turinčių abiejų grupių savybių. Taip yra dėl to, kad jų paskutinėje orbitoje yra keturi atomai, tai yra tarpinis metalų ir nemetalų kiekis.
Šie cheminiai elementai praleidžia elektros energiją tik viena kryptimi, neleidžiant tai daryti priešinga kryptimi, kaip tai daroma metaluose. To pavyzdys yra silicis (Si) - metalloidas, naudojamas šios savybės dėka elektronikos pramonei skirtų puslaidininkinių elementų gamyboje.
Kiti metalloidai yra: boras (B), arsenas (As), stibis (Sb) ir polonis (Po).

4. Halogenai
Halogenai yra šešių elementų grupė jie linkę sudaryti molekules, sudarytas iš dviejų atomų (diatominių), kurios yra labai chemiškai aktyvios dėl savo elektronegatyvumo.
Šios medžiagos dažniausiai būna jonų pavidalu, tai yra elektra įkrautos molekulės, kurios šiuo atveju yra mononegatyvios, labai oksiduojančios. Tai reiškia, kad halogenai yra ėsdinančios ir ėsdinančios medžiagos.
Halogenai yra: fluoras (F), chloras (Cl), bromas (Br), jodas (I), astatas (At) ir tenesis (Ts).

5. Tauriosios dujos
Tauriosios dujos yra septynių asmenų grupė, kurios natūrali būsena yra dujinė. Paprastai jie atsiranda diatominių molekulių pavidalu, kurių reaktyvumas yra labai mažas, tai yra, jie nereaguoja su kitais elementais, sudarančiais kitas medžiagas ir dėl tos pačios priežasties jos vadinamos inertinėmis dujomis. Taip yra todėl, kad paskutinėje orbitoje yra didžiausias įmanomas to lygio elektronų skaičius, iš viso aštuoni.
Šią elementų grupę sudaro helis (He), neonas (Ne), argonas (Ar), kriptonas (Kr), ksenonas (Xe), radonas (Rn) ir oganesonas (Og), anksčiau žinomi kaip ununctiumas.


