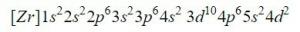De 11 typene kjemiske reaksjoner
De forskjellige stoffene som finnes i naturen samhandler kontinuerlig med hverandre. Ting som er så vanlige som å tenne en fyrstikk, oppløse et medikament i vann eller til og med å puste, adlyder det som kalles kjemiske reaksjoner.
I denne artikkelen skal vi se noen av de vanligste typene av kjemiske reaksjoner, samt forklaringer om deres mekanikk og effektene som disse interaksjonene mellom molekyler gir.
Kjemisk reaksjon: forklaring av konseptet
Vi forstår ved kjemisk reaksjon alt det samspillet mellom stoffer der de genereres eller brytes kjemiske lenker, genererer nye forbindelser. De opprinnelige forbindelsene kalles reaktanter, mens resultatet av reaksjonen er produktene.
Disse reaksjonene kan være reversible i noen tilfeller, og være i stand til å bringe reagensene tilbake til sin forrige tilstand, men i andre tilfeller blir de konsumert når reaksjonen er irreversibel. Når reaksjonen finner sted, er det et øyeblikk når det oppstår en likevekt mellom reaktant og produkt og reaksjonen opphører.
Uansett blir atomer verken skapt eller ødelagt, men bare transformert, slik det skjer med bevaring av energi. Kjemiske reaksjoner er et eksempel på hvordan de kan transformere seg og gå fra å være en del av noen molekyler til å være i andre.
Hovedtyper av kjemisk reaksjon
Det er et stort antall mulige måter som samspillet mellom forbindelser oppstår, med forskjellige egenskaper og særegenheter. Noen av hovedtyper av kjemiske reaksjoner mellom forbindelser er som følger.
1. Syntese eller tilleggsreaksjoner
I denne typen kjemisk reaksjon kombineres to eller flere stoffer for å danne en enkelt forbindelse.. Kombinasjonen av metall og oksygen for å danne oksider er et eksempel, siden det gir opphav til relativt små molekyler. stabil som i noen tilfeller kan brukes til å produsere vanlige materialer i våre liv hver dag.
2. Nedbrytningsreaksjoner
Nedbrytningsreaksjoner er de der en bestemt forbindelse spaltes og deles i to eller flere stoffer. Dette er hva som for eksempel skjer når elektrolyse av vann skjer, og skiller vannet i hydrogen og oksygen.
3. Forskyvning, erstatning eller utvekslingsreaksjoner
En av typene kjemisk reaksjon der et grunnstoff i en forbindelse overføres til en annen på grunn av dets interaksjon. I dette tilfellet tiltrekkes det gjennomhullede elementet av den andre komponenten, som må ha større styrke enn den opprinnelige forbindelsen.
4. Joniske reaksjoner
Det er en type kjemisk reaksjon som oppstår når ioniske forbindelser utsettes for et løsningsmiddel.. Den løselige forbindelsen oppløses og dissosierer seg til ioner.
5. Doble substitusjonsreaksjoner
Det er en reaksjon som ligner på substitusjon, med unntak av at i dette tilfellet passerer det ene av elementene som utgjør en av forbindelsene den andre samtidig som denne andre forbindelsen overfører en av sine egne komponenter til den første. Det er nødvendig for reaksjonen at minst en av forbindelsene ikke oppløses.
6. Redoks eller redoksreaksjoner
Det kalles som sådan den typen kjemisk reaksjon der det er utveksling av elektroner. I oksidasjonsreaksjoner mister den ene forbindelsen elektroner til fordel for den andre og oksiderer. Den andre forbindelsen ville bli redusert ved å øke antallet elektroner.
Disse typer reaksjoner forekommer både i naturen og kunstig. For eksempel er det typen reaksjon som får oss til å trenge å puste (ved å skaffe oksygen fra miljøet) eller at planter skal utføre fotosyntese.
7. Forbrenningsreaksjoner
En type ekstremt rask og energisk oksidasjon, der et organisk stoff reagerer med oksygen. Denne reaksjonen genererer energi (vanligvis varme og lys) og kan generere flammer, noe som vanligvis resulterer i et produkt i form av en gass. Et typisk eksempel er forbrenning av hydrokarbon eller forbruk av glukose.
8. Nøytraliseringsreaksjoner
Denne typen kjemisk reaksjon oppstår når en basisk substans og en sur substans de samhandler på en slik måte at de blir nøytralisert for å danne en nøytral forbindelse og vann.
9. Atomreaksjoner
Det kalles som sådan all den kjemiske reaksjonen der en modifisering ikke er forårsaket av elektronene til atomene, men av kjernen deres. Denne kombinasjonen eller fragmenteringen vil føre til et høyt nivå av energi. Kombinasjonen av atomer kalles fusjon, mens fragmenteringen av dem kalles fisjon.
10. Eksoterme reaksjoner
Det kalles en endoterm reaksjon på all den kjemiske reaksjonen som forårsaker utslipp av energi. Generelt er disse energifølelsene i det minste i form av varme, men i tilfeller der eksplosjoner oppstår, vises også kinetisk energi.
11. Endotermiske reaksjoner
Endotermiske reaksjoner er alle de typene kjemisk reaksjon der samspillet mellom elementene absorberer energi fra miljøet, som er sluttproduktet mye mer energisk enn reagensene.
Forklarer kjemiske reaksjoner verden?
Et reduksjonistisk syn på virkeligheten kan få oss til å tenke at nesten alt som skjer i verden kan forstås som kjemiske reaksjoner. For eksempel er ideen om at menneskelig bevissthet faktisk er et resultat av biokjemiske reaksjoner i hjernen populær.
Denne tankegangen basert på samspillet mellom subatomære elementer, atomer og molekyler (og deres tilsvarende reaksjonstyper kjemisk) er intuitiv og lett å bli gravid, siden den starter fra en serie relativt enkle og identiske elementer i alle deler av kosmos, Det er ment å forklare kompleksiteten til fenomenene som oppstår i større skala og som er knyttet til unike og ugentlige sammenhenger. Vi antar at for å forstå komplekset, må vi begynne med det som ikke er så komplekst og uten hvilket resten av naturen (inkludert her det menneskelige) ikke ville eksistere.
Det må imidlertid ikke glemmes at naturen er for kompleks til å bare studeres gjennom denne delen av vitenskapen, på samme måte som det ville være utilstrekkelig å studere den utelukkende fra fysisk. Vi må også ta hensyn til fenomener som oppstår på makronivå, for å nå en grad av global forståelse om hva som skjer rundt oss og i vår egen organisme.
Bibliografiske referanser:
- Armstrong, J. (2012). Generell, organisk og biokjemi: En anvendt tilnærming. New York: Brooks / Cole.
- Atkins, P. W.; de Paula, J. (2006). Fysisk kjemi (4. utgave). Weinheim: Wiley-VCH.
- Baldor, F. TIL.; Baldor, F. J. (2002). Uorganisk kjemisk nomenklatur. Mexico D. F.: Velger.
- Birkholz, M. (2014). Modellering av formen til ioner i krystaller av pyritt-type. Krystaller. 4 (3): 390 - 403.
- Bunch, B.H. og Hellemans, A. (2004). Historien om vitenskap og teknologi. Houghton Mifflin Harcourt.
- Makhijani, A.; Saleska, S. (2001). Grunnleggende om kjernefysikk og fisjon. Institutt for energi- og miljøforskning.
- Wintterlin, J. (1997). Atomiske og makroskopiske reaksjonshastigheter for en overflatekatalysert reaksjon. Vitenskap. 278 (5345): 1931 - 1934.