Štruktúra a vlastnosti atómu

Obrázok: SlidePlayer
Atómy sú súčasťou nášho sveta. Celá hmota je tvorená atómami, takže je dôležité lepšie pochopiť, z čoho pozostávajú a aké sú ich funkcie. V tejto lekcii od UČITEĽA vám povieme, čo štruktúra atómu a vlastnosti. Ak sa chcete dozvedieť viac o časticiach, z ktorých pozostáva celá hmota, pokračujte v čítaní tohto článku.
Register
- Čo sú to atómy?
- Štruktúra atómu
- Hlavné charakteristiky atómu
- Čo sú to izotopy?
- Ako sa nachádzajú atómy v prírode?
Čo sú to atómy?
The atóm to je najmenšia jednotka, na ktorú možno hmotu rozdeliť bez straty svojich chemických vlastností, teda vlastností ako chemického prvku. Atóm je pôvodcom všetkého, čo je možné vidieť alebo sa ho dotknúť, od hviezd až po vaše dnešné raňajky.
Ak odložíme stratu jeho chemických vlastností, môžeme povedať, že atóm je tvorený rôznymi časticami, ktoré sa nazývajú subatomárne častice. Existujú tri typy subatomárnych častíc -protóny, neutróny a elektróny- s rôznymi charakteristikami.
Tieto častice sú zoskupené v rôznych počtoch, aby vytvorili chemické prvky (kyslík, uhlík atď.), Ale vždy sa budú distribuovať podľa pevnej štruktúry.

Obrázok: Webové stránky Google
Štruktúra atómu.
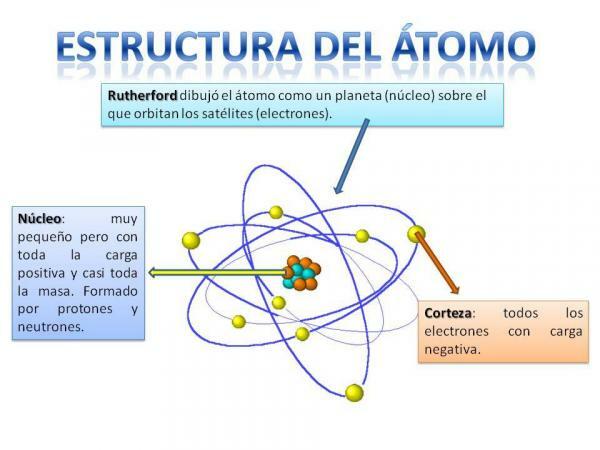
Štruktúra atómu je nemenná, to znamená, že môžeme mať rôzne typy atómov (atóm vodíka, atóm kyslíka atď.), ale ich subatomárne častice sú vždy usporiadané podobným spôsobom ako planetárny systém.
Určite si spomeniete, ako je usporiadaná slnečná sústava: Slnko je v strede a okolo z tohto sa planéty otáčajú a popisujú rôzne dráhy, niektoré bližšie a iné vzdialenejšie k Slnko. V prípade atómov je v strede znak jadro, s tvarom podobným ako ostružina a je zložený z: neutróny a protóny.
Okolo jadra je Cortex čo je oblasť, cez ktorú elektróny. Predtým sa myslelo, že elektróny popisujú určité dráhy, podobne ako to robia planéty, hoci teraz je to tak vie, že tieto obežné dráhy nie sú tak presne definované a podobajú sa skôr oblastiam, v ktorých sa nachádzame s väčšou pravdepodobnosťou elektróny.
Obrázok: REA - plán Ceibal
Hlavné charakteristiky atómu.
Pre pokračovanie v tejto lekcii o štruktúre atómu a charakteristikách je dôležité zamerať sa na prvky, vďaka ktorým sa atóm považuje za taký.
A preto si musíme odpovedať na túto otázku: Prečo sa všetky atómy rozhodujú takýmto spôsobom? Odpoveď je jednoduchá: je to kvôli elektrické príťažlivé sily. Jadro atómu tvoria neutróny, ktoré nemajú elektrický náboj, a protóny, ktoré majú kladný elektrický náboj. a elektróny majú negatívny elektrický náboj, takže medzi jadrom a elektrónmi existuje podobná príťažlivá sila produkovaný medzi dvoma pólmi magnetu, ale nie je dosť silný na to, aby elektróny „padli“ k jadro.
To je lepšie pochopiť, ak vezmeme do úvahy veľkosť jadra: ak by atóm mal napríklad rozmer futbalového štadióna, jadro by malo rozmer lopty v strede z ihriska Koľko príťažlivej sily by musela urobiť futbalová lopta, aby na ňu dopadli tribuny štadióna!
Funkcia neutrónov
Možno sa teraz pýtate, a akú úlohu majú neutróny? Napriek tomu, že nemajú elektrický náboj, majú neutróny v atóme veľkú úlohu: prispievajú 99% hmotnosti. Ak vám to pomôže zapamätať si, môžeme povedať, že atóm je ako banda troch priateľov: ťažký neutrón, pozitívny protón a záporný elektrón, ktoré obiehajú neutróny a elektrón.
Pohyb elektrónov
V tejto chvíli chcem, aby sme sa vrátili k niečomu, čo nám zostalo v kalamári: obežné dráhy, ktoré elektróny popisujú okolo jadra. To sme povedali elektróny sa otáčajú okolo jadra tak ako to robia planéty okolo Slnka, niektoré bližšie ako iné, prečo to robia? Elektróny sa otáčajú v jednej alebo druhej škrupine podľa energie, ktorú majú na to, aby sa vzdialili od jadra, to znamená, že tie elektróny, ktoré sú bližšie k jadru, nemajú dostatočná sila na to, aby sa vzdialila od jadra, zatiaľ čo tie v najvzdialenejších škrupinách (orbitáloch) kôry majú viac energie a boli schopné sa vzdialiť ďalej od jadra. jadro. Ďalej je na každom z orbitálov maximálna kapacita 8 elektrónov (oktetové pravidlo).
Častice atómu
Vrátime sa k ďalšiemu prístupu, ktorý sme vykonali predtým, ale nevysvetlili sme ho: atómy sú tvorené neutróny, protóny a elektróny, ktoré vždy kombinujú rovnakú štruktúru jadra a kôry, ale vytvárajú rôzne chemické prvky v rôznych počtoch. Ako môžeme získať toľko prvkov kombinujúcich iba 3 typy častíc? Chemické prvky, ktoré ste kedy videli v periodickej tabuľke, sú charakteristické tým, že majú určité atómové číslo.
The atómové číslo (Z) Hovorí nám počet protónov v jadre tohto typu atómu, ktorý sa rovná počtu elektrónov za normálnych podmienok. Napríklad napríklad všetky atómy, ktoré majú 6 protónov (Z = 6), budú atómami uhlíka a budú mať rovnaké chemické vlastnosti; atómy s 5 protónmi (Z = 5) budú atómy bóru, s rovnakými chemickými vlastnosťami ako sú uhlíkové atómy. Atómové číslo si nemusíte zamieňať s atómovou hmotnosťou alebo číslo hmotnosti (A), čo je súčet hmotnosti neutrónov a protónov (hmotnosť elektrónov je zanedbateľná vzhľadom na hmotnosť celkového jadra).

Obrázok: SlidePlayer
Čo sú to izotopy?
V prírode nájdeme rôzne „podtypy“ prvkov, tzv izotopy. Som si istý, že ste niekedy počuli o uhlíku 14, rádioaktívnom izotope uhlíka, ktorý sa používa okrem iného na určenie veku fosílií. Izotopy sú dva atómy s rovnakým počtom protónov (rovnaké atómové číslo), ale odlišný počet neutrónov (rozdielna atómová hmotnosť). Izotopy toho istého prvku sú zvyčajne pomenované podľa názvu prvku, za ktorým nasleduje jeho atómová hmotnosť.
V našom príklade sú oba izotopy uhlík, takže majú atómové číslo 6 (Z = 6), ale uhlík 12 („normálny“ uhlík) má atómovú hmotnosť 12 oproti atómovej hmotnosti uhlíka 14 14. Izotopy toho istého prvku majú veľmi podobné chemické a fyzikálne vlastnosti. V prípade uhlíka 14 je to na rozdiel od uhlíka 12 rádioaktívny izotop, ktorý je prítomný vo všetkých prvkoch obsahujúcich uhlík vrátane živých bytostí.
A týmto končíme túto lekciu o štruktúre atómu a charakteristikách. Dúfame, že vám pomohla.

Obrázok: Vaše úlohy
Ako sa nachádzajú atómy v prírode?
Atómy možno nájsť izolovane, ale najbežnejšie je ich nájsť kombinované v skupinách zavolal molekuly.
Molekuly môžu byť tvorené atómami toho istého prvku (napríklad molekuly kyslíka zložené z dvoch atómov uhlíka) kyslík) alebo skupinami s atómami rôznych prvkov (dva atómy vodíka a jeden z kyslíka tvoria molekulu Voda). Tieto skupiny prvkov sa nazývajú molekuly, ktoré sa zase dajú navzájom kombinovať a formovanie rôznych čoraz zložitejších zoskupení podľa ich reaktivity a chemickej afinity k Zdroj chemické odkazy.
Ak si chcete prečítať viac podobných článkov Štruktúra a vlastnosti atómu, odporúčame vám vstúpiť do našej kategórie Atóm.


