Aké sú VALENCIE DUSÍKA

Dusík je veľmi dôležitý chemický prvok v našom živote, Aj v dobrom aj v zlom. Je to hlavný plyn v atmosfére, nachádza sa v pôde a je to veľmi dôležitá makromolekula pre väčšinu živých bytostí. Je tiež súčasťou zlúčenín veľkého priemyselného významu, ako je amoniak, hnacie plyny alebo výbušniny.
Čo sa stane, je, že jeho mocenstvo a oxidačný stav sa líšia v závislosti od zlúčeniny. V tejto lekcii od UČITEĽA budeme hovoriť o tom aké sú valencie dusíka. Ak máte záujem dozvedieť sa o tomto chemickom prvku, tento článok sa vám bude páčiť!
Index
- Čo je dusík a vlastnosti
- Aké sú valencie dusíka?
- Názvoslovie dusíkatých zlúčenín
- Dôležité zlúčeniny dusíka
- Účinky dusíka na zdravie
- Environmentálne účinky dusíka
Čo je dusík a vlastnosti.
Dusík je chemický prvok so symbolom N. s atómovým číslom 7, atómovou hmotnosťou 14,0067 a za normálnych podmienok sa nachádza v plynnom stave. Molekulárny dusík predstavuje 78 % objemu suchého vzduchu a je preto hlavným plynom prítomným v atmosfére.
Táto vysoká koncentrácia dusíka v atmosfére je výsledkom elektrického pôsobenia v atmosfére, fixácie atmosférického dusíka bakteriálne pôsobenie, chemické pôsobenie v priemysle a uvoľňovanie dusíka rozkladom organickej hmoty alebo prostredníctvom spaľovanie. Vo svojich zlúčeninách tvoriacich kombinovaný stav sa dusík nachádza v rôznych stavoch.
Je to prvok veľkého významu pre živé bytosti, od r Je súčasťou všetkých bielkovín rastlinné aj živočíšne a mnohé ďalšie organické zlúčeniny. Dusík vytvára silné väzby s inými atómami, ako je dusík a iné, vďaka svojej schopnosti tvoria trojité väzbyPreto zlúčeniny dusíka majú veľké množstvo energie.
Dusík pozostáva z dva izotopy:
- N14 (veľká väčšina)
- N15 a rôzne rádioaktívne izotopy, ktoré vznikajú pri jadrových reakciách.
Je to prvok veľkého záujmu v chemickom priemysle a v zlúčeninách používaných v poľnohospodárstve. Používa sa tiež v žiarovkách a keď je potrebná relatívne inertná atmosféra.
Dusík vo svojej elementárnej forme je pri bežných teplotách mierne reaktívny s väčšinou bežných látok, zatiaľ čo pri zvýšených teplotách reaguje s mnohými látkami, ako je titán, hliník, kremík, bór, berýlium, vápnik, lítium alebo chróm, s kyslíkom (O2) reaguje na tvoria oxidy ako oxid dusný (NO) a s vodíkom pri vysokých teplotách a tlaku vytvárajú veľmi dôležitú priemyselnú zlúčeninu ako napr. amoniak.
Zdroj obrázkov: Monographs.com
Aké sú valencie dusíka?
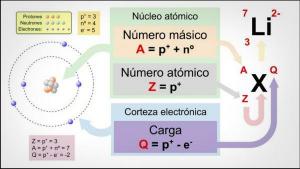
The valencie chemického prvku je on? číslo od elektróny čo chýbajú alebo čo by mali dať na vyplnenie vašej poslednej elektronickej úrovne.
The atómov zvyčajne majú 7 úrovní alebo vrstiev kde sa nachádzajú elektróny, pričom 1 je najvnútornejší a 7 najvzdialenejší. Na druhej strane existujú rôzne podúrovne, nazývané s, p, d a f. V atóme elektróny napĺňajú rôzne úrovne podľa svojich energií, pričom najskôr plnia nižšie energetické úrovne a potom sa presúvajú na vyššiu úroveň.
K vonkajšia úroveň atómu nazýva sa aj ako valenčná škrupina a elektróny nachádzajúce sa v tomto obale sa nazývajú valenčné elektróny. Tieto elektróny sú zodpovedné za tvorbu väzieb a možné chemické reakcie. s inými atómami, to znamená, že sú to elektróny zodpovedné za fyzikálne a chemické vlastnosti a prvok.
Rôzne spôsoby, akými sa dusík kombinuje, mu dávajú valenciu (známu aj ako oxidačný stav). Dusík nie je schopný rozširovať svoj valenčný obal, ako to robia ostatné prvky v jeho skupine. Jeho možné valencie sú -3, +3 a +5. Valenčný stav dusíka sa mení v závislosti od zlúčeniny, ktorej je súčasťou. Ostatné prvky z rodiny dusíka majú tiež tieto oxidačné stavy a sú to fosfor (P), antimón (Sb), bizmut (Bi), moskovium (Mc) a arzén (As).
Vznik chemických zlúčenín s dusíkom možno vysvetliť podľa teórie valenčných väziebpodľa elektronickej konfigurácie každého oxidačného stavu dusíka. Na vysvetlenie sa berie do úvahy počet elektrónov v jeho valenčnom obale a to, koľko chýba na dosiahnutie elektrónovej konfigurácie vzácneho plynu.

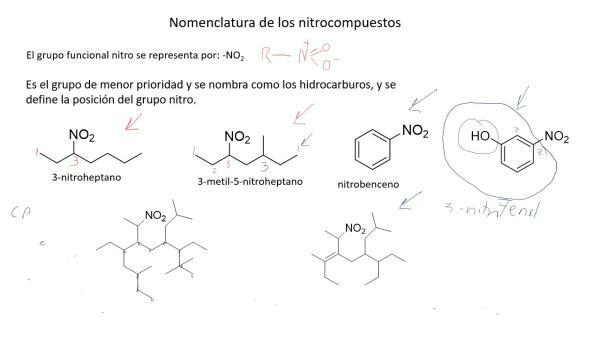
Názvoslovie dusíkatých zlúčenín.
Zlúčeniny dusíka sú chemicky zložité a tradičná nomenklatúra nestačila na ich ľahké pomenovanie a identifikáciu, takže ktorú vytvorila Medzinárodná únia čistej a aplikovanej chémie (IUPAC) (aj kvôli iným faktorom) a systematická nomenklatúra v ktorých sú zlúčeniny pomenované podľa počtu atómov, ktoré ich tvoria.
Toto názvoslovie je vhodné najmä na pomenovanie oxidov dusíka. Oxid dusnatý sa teda nazýva oxid dusnatý a oxid dusný (NO), oxid dusný (N2O).
Okrem tejto nomenklatúry v roku 1919 nemecký chemik Alfred Stock vyvinul metódu, v ktorej boli zlúčeniny pomenované v závislosti od oxidačného stavu, znázornené rímskymi číslicami a v zátvorkách. Týmto spôsobom by sa oxid dusnatý nazýval oxid dusíka (II) a oxid dusný, oxid dusíka (I).
Obrázok: Youtube
Dôležité zlúčeniny dusíka.
Dusík je schopný viazať sa na rôzne prvky a vytvárať veľké množstvo zlúčenín kvôli veľkému počtu možných oxidačných stavov. V prípade molekulárneho dusíka je jeho valencia podľa definície 0.
Jeden z najbežnejších oxidačných stavov je -3. V tomto oxidačnom stave dusík tvorí zlúčeniny, ako je amoniak (NH3), amónny ión (NH4-nitrily (C=N), imíny (C=N-R) alebo amíny (R3N). Keď je dusík v oxidačnom stave -2, v jeho valenčnom obale zostáva 7 elektrónov. Nepárny počet elektrónov v jeho valenčnom obale uľahčuje vytváranie premosťovacích väzieb medzi dvoma atómami dusíka. V tomto stave dusík tvorí hydrazóny (C=N-N-R2) a hedrazíny (R2-N-N-R2). V oxidačnom stave -1 zostáva vo valenčnom obale 6 elektrónov a vznikajú zlúčeniny ako hydroxylamín (R2NOH) a azozlúčeniny (RN=NR).
Keď dusík dosiahne kladné oxidačné stavy, Dusík sa viaže na atómy kyslíka za vzniku oxidov, oxykyselín alebo oxysolí. V oxidačnom stave +1 zostanú dusíku vo valenčnom obale 4 elektróny. Máme teda príklady ako oxid dusný (N2O), ľudovo známy ako rajský plyn, a zlúčeniny dusíka (R=NO). V stave +2 máme oxid dusnatý alebo oxid dusnatý (NO), čo je bezfarebný plyn, ktorý vzniká pri reakcii kovov so zriedenou kyselinou dusičnou. Táto zlúčenina má veľmi nestabilný voľný radikál, ktorý môže reagovať s kyslíkom za vzniku dôležitej látky znečisťujúcej ovzdušie, ako je oxid dusičitý (NO2).
V stave +3 vznikajú zlúčeniny ako dusitany v zásaditom roztoku (NO2–) alebo kyselina dusitá v kyslom roztoku (HNO2). Obidve sú oxidačné činidlá, ktoré môžu viesť k vzniku oxidu dusnatého (NO) alebo môžu byť redukčnými činidlami za vzniku dusičnanového iónu. Ďalšími zlúčeninami sú oxid dusný (N2O3) a nitroskupina (R-NO2). V stave +4 máme oxid dusičitý (NO2) alebo oxid dusičitý. Je to hnedo sfarbený plyn, ktorý vzniká reakciou mnohých kovov s koncentrovanou kyselinou dusičnou za vzniku oxidu dusného (N2O4). Pri +5 nájdeme dusičnany alebo kyselinu dusičnú, čo sú oxidačné činidlá v kyslých roztokoch.
nakoniec Existujú zlúčeniny, v ktorých je dusík v rôznych oxidačných stavoch.. Sú to zlúčeniny ako nitrosilazid alebo oxid dusný.
Obrázok: Ambientum
Účinky dusíka na zdravie.
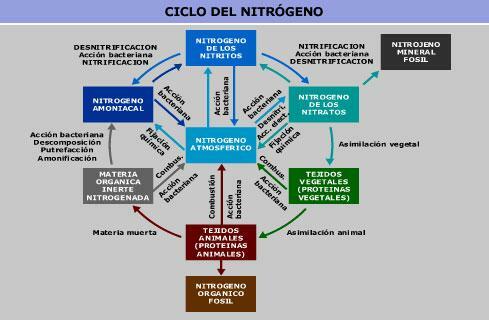
Molekulárny dusík je hlavnou plynnou zložkou atmosférického plynu. Vo vode a pôde ho nájdeme vo forme dusičnanov a dusitanov. Všetky tieto zlúčeniny sa navzájom spájajú v cykle dusíka.
Ľudská činnosť zmenila koncentrácie dusičnanov a dusitanov na pôde, najmä prostredníctvom aplikácie hnoja s dusičnanmi na pôdu. Okrem toho sa koncentrácia dusičnanov a dusitanov v pôde a vode zvyšuje dusíkom emitovaným priemyselnými odvetviami prostredníctvom cyklu dusíka. To by mohlo viesť aj k zvýšeniu dusíka v pitnej vode.
The účinky dusičnanov a dusitanov na ľudské zdravie môžu byť:
- Dusičnany majú negatívny vplyv na činnosť štítnej žľazy
- Dusičnany znižujú ukladanie vitamínu A
- Dusičnany aj dusitany produkujú nitrozamíny, ktoré sú častou príčinou rakoviny
- Dusitany reagujú s hemoglobínom, čo spôsobuje zníženie kapacity krvi prenášať kyslík.
- Oxid dusnatý (NO) je základným posolom v ľudskom tele, ktorý spôsobuje relaxáciu svalov, prospieva kardiovaskulárnemu systému alebo má signalizačné účinky na bunky imunitný systém. Tieto účinky sa už využívajú vo viacerých medicínskych aplikáciách, ako sú lieky proti infarktu alebo Viagra.
Environmentálne účinky dusíka.
Pridávanie dusičnanov a dusitanov do hnojív spôsobuje zvýšenie ich environmentálnych koncentráciíako aj rôzne priemyselné procesy. Mnohé z týchto zlúčenín môžu uniknúť do atmosféry a reagovať s kyslíkom, čím vznikajú látky znečisťujúce ovzdušie, ktoré podporujú zosilnenie skleníkového efektu.
Dusičnany a dusitany majú nepriaznivé účinky aj v sladkej vode a v morskom prostredí, negatívne ovplyvňujúce tento ekosystém a druhy ktoré ho obývajú. Koncentrácie týchto dusíkatých zlúčenín v pitnej vode sa tiež drasticky zvyšujú, čo má negatívny vplyv na ľudské zdravie.
Ak si chcete prečítať viac podobných článkov ako Aké sú valencie dusíka, odporúčame vám zadať našu kategóriu Atóm.
Bibliografia
- Mayz-Figueroa, J. (2004). Biologická fixácia dusíka. Poľnohospodársky vedecký časopis UDO, 4(1), 1-20.
- Celaya-Michel, H., & Castellanos-Villegas, A. A. (2011). Mineralizácia dusíka v pôde suchých a polosuchých zón. Terra Latinoamericana, 29(3), 343-356.
- Cárdenas-Navarro, R., Sánchez-Yáñez, J. M., Farías-Rodríguez, R., & Peña-Cabriales, J. J. (2004). Vstupy dusíka do poľnohospodárstva. Záhradnícka séria časopisu Chapingo, 10 (2), 173-178.