MOLEKULÁRNA geometria: definícia a príklady
The trojrozmerný tvar v ktorej sú usporiadané atómy tvoriace molekulu, je známe pod menom molekulárna geometria alebo molekulárna štruktúra.
Geometriu týchto molekúl je možné odvodiť z teoretického modelu: odpudivý model párov elektrónov vo valenčnom plášti (RPECV). Tento model je obzvlášť užitočný na znázornenie geometrie molekúl zložených z malých atómov a navzájom spojených kovalentnými väzbami (zdieľanie elektrónov).
V tejto lekcii od UČITEĽA objavíme definícia molekulárnej geometrie a príklady Takže sa týmto spôsobom dozviete, z čoho pozostáva model RPECV, ako je možné pomocou tejto metódy a niektorých príkladov odvodiť geometriu molekúl.
Register
- Definícia molekulárnej geometrie
- Príklady molekulárnej geometrie
- Poznajte Lewisovu štruktúru molekuly
- Model odpudzovania elektrónových párov valenčnej škrupiny (RPECV)
Definícia molekulárnej geometrie.
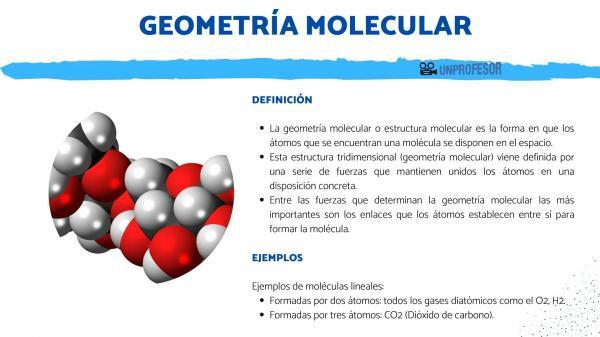
Molekulárna geometria alebo molekulárna štruktúra je spôsob atómov našla molekulu sú usporiadané v priestore.
Táto trojrozmerná štruktúra (molekulárna geometria) prichádza definované sériou síl ktoré držia atómy pohromade v špecifickom usporiadaní. Medzi silami, ktoré určujú molekulárnu geometriu, sú najdôležitejšie odkazy že atómy ľahnúť si navzájom do tvoria molekulu.
Geometria molekúl je veľmi dôležitá pretože určuje, aké sú fyzikálno-chemické vlastnosti hmoty. Napríklad: Molekuly H2O majú uhlovú geometriu, ktorá je daná väzbami, ktoré ju tvoria. Prijatie tejto uhlovej geometrie robí z molekuly vody elektrický dipól a má výnimočné vlastnosti. Vďaka svojej geometrii je voda pri izbovej teplote tekutá, je schopná rozpúšťať veľa látok atď.
Je zrejmé, že vzhľadom na veľkosť molekúl nie je možné priamo pozorovať ich geometriu a je potrebné ich odvodiť nepriamymi metódami. Ďalej je potrebné tieto geometrie znázorniť pomocou teoretických modelov.
Práve tieto teoretické modely nám umožňujú určiť, aká je geometria molekuly z jej molekulárneho vzorca.
Príklady molekulárnej geometrie.
Ako sme videli v predchádzajúcej časti, atómy tvoriace molekulu môžu nadobúdať rôzne priestorové usporiadania (geometrie). V tejto časti uvidíme niekoľko príkladov molekulárnej geometrie.
Dvojrozmerné geometrie
V niektorých prípadoch molekuly získavajú ploché alebo dvojrozmerné geometrie, to znamená, že sú to štruktúry, ktoré majú iba dva rozmery a zaberajú povrch (nemajú objem).
Lineárna geometria
Je to najjednoduchšia geometria, ide o molekuly, ktorých atómy sú spojené a vytvárajú priamu čiaru. Všetky molekuly zložené z dvoch atómov sú lineárne, ale táto geometria sa vyskytuje aj v molekulách zložených z troch atómov.
Príklady lineárnych molekúl:
Tvorené dvoma atómami: všetky dvojatómové plyny ako O2, H2.
Skladá sa z troch atómov: CO2 (oxid uhličitý).
Uhlová geometria
Sú to molekuly zložené z troch atómov, ktoré sa navzájom spájajú pod určitým uhlom. Amplitúda vytvoreného uhla môže byť rôzna, v závislosti od typu atómov, ktoré ho tvoria. Amplitúdy uhlov tvorených uhlovými molekulami majú hodnoty medzi 90 ° a 120 °.
Príklady: H2O, SO2 (oxid siričitý), SnCl2 (chlorid cínatý)
Trojuholníková geometria
Sú to molekuly zložené zo štyroch atómov, pričom jeden atóm sa nachádza v strede imaginárneho trojuholníka a ďalšie tri zvyšné atómy sa nachádzajú v každom z vrcholov tohto trojuholníka.
Príklady: SO3 (oxid sírový), NO3- (dusičnanový ión)
Štvorcová geometria
Molekuly s touto geometriou majú 5 atómov. Jeden je umiestnený v strede štvorca a ďalšie 4 v každom z vrcholov obrázku.
Príklady: XeF4 (xenon trifluorid)
Trojrozmerné geometrie
Majú tri rozmery, to znamená, že majú objem. Geometrie 3D molekúl sú veľmi rozmanité, tu uvedieme iba niekoľko príkladov.
Štvorboká geometria
Táto geometria je geometria prezentovaná niektorými molekulami tvorenými piatimi atómami, v ktorých sa nachádza atóm stred imaginárnej kocky a štyri zvyšné atómy sú umiestnené na vrcholoch kocky (štvorsten).
Príklad: CH4 (metán), Mn04-(manganistanový ión)
Trojuholníková pyramídová geometria
Sú to molekuly so štyrmi atómami usporiadané na štyroch vrcholoch pyramídy s trojuholníkovou základňou.
Príklad: NH3 (amoniak), PH3 (fosfín)
Štvoruholníková pyramídová geometria
V tomto prípade je počet atómov, ktoré tvoria molekulu, šesť a päť z nich je usporiadaných v vrcholy pyramídy so štvorcovou základňou, zatiaľ čo šiesty zaberá stred štvorca základňa.
Príklad: ClF5 (chlórpentafluorid)
Poznajte Lewisovu štruktúru molekuly.
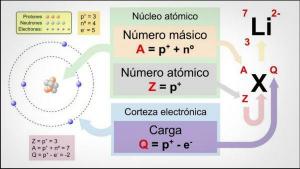
Skôr ako začnete používať Metóda RPECV je potrebné vedieť, o čo ide Lewisova štruktúra molekuly a kvôli tomu musíte najskôr vedieť, čo elektronická konfiguráciaz vrstvy Valencie rôznych atómov, ktoré tvoria molekulu.
Preto predtým, ako budete môcť určiť geometriu molekuly, je potrebné vykonať niekoľko predbežných krokov:
- TO. Získajte elektrónové konfigurácie rôznych atómov, ktoré tvoria molekulu.
- B. Určte počet valenčných elektrónov obalu každého z atómov. Elektróny vo valenčnom plášti sú elektróny, ktoré atóm môže použiť na vytvorenie väzieb.
- C. Dedukujte Lewisovu štruktúru s prihliadnutím na to, koľko elektrónov má každý atóm vo svojej valenčnej škrupine.
Obrázok: Prehrávač obrázkov
Model odpudzovania elektrónových párov valenčnej škrupiny (RPECV)
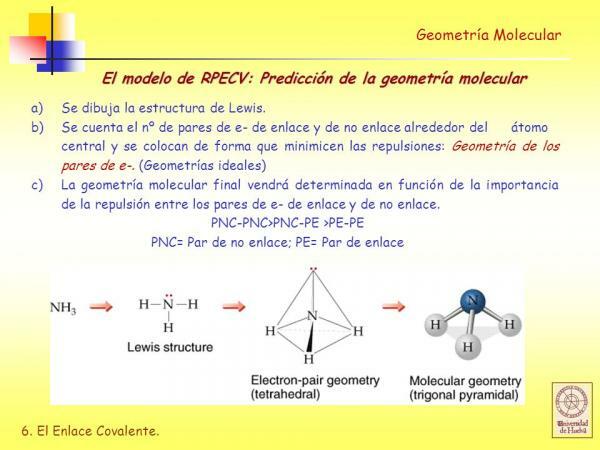
V Lewisove štruktúry každý z viazaných atómov musí spĺňať oktetové pravidlo. Keď atóm spĺňa oktetové pravidlo, je obklopený štyrmi pármi elektrónov, ktoré môžu byť elektrónmi, ktoré sú súčasťou väzba (väzobné elektrónové páry) alebo páry elektrónov, ktoré sa nezúčastňujú na tvorbe väzby (elektrónové páry nie väzba).
Ako uvidíme, akonáhle je určená Lewisova štruktúra molekuly, odvodíme ju geometria pomocou odpudzovacieho modelu valenčných škrupín elektrónových párov je veľmi ľahké.
Podľa tohto modelu znázornenia sú ligandy (X) a neviazané elektrónové páry (E) usporiadané okolo centrálneho atómu (A), takže vzdialenosť medzi nimi je maximálna. Súčet ligandov a neviazaných elektrónových párov (X + E) určuje typ geometrie molekuly.
X + E = 2
Lineárna geometria
AX2: Molekula tvorená dvoma atómami ligandu pripojenými k centrálnemu atómu
Príklad: hydrid berýlia (BeH2).
X + E = 3
Geometria trojuholníkovej roviny (rovnostranný trojuholník)
AX3: Molekula pozostávajúca z troch atómov pripojených k centrálnemu atómu
Príklady: Niektoré chloridy, ako je bór alebo hliník (BCI3, AlCl3).
Uhlová geometria (uhol 120 °)
AX2E: Molekula s centrálnym atómom pripojeným k dvom ligandom a dvojici neviazaných elektrónov.
Príklady: chlorid cínatý (Sn2Cl)
X + E = 4
Štvorboká geometria
AX4: Molekuly s centrálnym atómom so štyrmi ligandmi usporiadanými do väzieb tak, aby ligandy boli majú na vrcholoch opačných uhlopriečok kocku, ktorej stred je samotný centrálny atóm.
Príklady: Molekuly ako metán (CH4), chlorid kremičitý (SiCl4) alebo tetrachlórmetán (CC14) vyjadrujú túto geometriu.
Geometria trigonálnej pyramídy
AX3E: Molekuly s 3 ligandmi a 1 voľným elektrónovým párom, v ktorých sú usporiadané atómy troch ligandov základňa pyramídy s trojuholníkovou základňou, v ktorej je centrálny atóm na hornom vrchole uvedeného pyramída
Príklady: jednou z molekúl, ktorá má túto geometriu, je amoniak (NH3).
Uhlová geometria (uhol 109 °)
AX2E2: Dva ligandy a centrálny atóm sú usporiadané a tvoria uhol 109 °
Príklady: Voda (H2O) je jednou z molekúl, ktoré majú túto geometriu.
Glineárna eometria
AX3: Pretože k centrálnemu atómu je pripojený iba jeden ligand, geometria je lineárna.
Príklad: fluorovodík alebo kyselina fluorovodíková (HF).
X + E = 5
Trojuholníková bipyramidálna geometria
AX5: Molekula má geometriu dvoch protiľahlých pyramíd, s trojuholníkovou základňou spoločnou pre obe. Centrálny atóm je usporiadaný v strede a ligandy sú umiestnené na vrcholoch.
Príklad: chlorid fosforečný (PCl5)
Dyshenoidálna geometria
AX4E: V tomto type geometrie atómy získavajú usporiadanie, ktoré sa podobá štruktúre hojdačky na hojdačke.
Príklad: Tetra fluorid sírový (SF4).
T geometria
AX3E2: Molekuly majú tvar písmena T, s ligandmi na koncoch písmena a centrálnym atómom v mieste, kde sa stretávajú dve čiary, ktoré ho tvoria.
Príklad: chlór trifluorid (ClF3)
Lineárna geometria
AX2E3: V tomto prípade sú tri atómy molekuly usporiadané v jednej línii s centrálnym atómom v medzipolohe.
Príklad: Xenon difluorid (F2Xe)
X + E = 6
Oktaedrická geometria
AX6: Tento typ molekuly má štruktúru, ktorá sa podobá osemstenu, v ktorom by centrálny atóm zaujímal stred geometrického obrazca a šesť ligandov, každý z jeho vrcholov.
Príklad: hexafluorid sírový (SF6)
Pyramída štvorcového základu
AX5E: V tomto prípade atómy tvoria obrazec, v ktorom centrálny atóm zaberá stred bázy a ligandy päť vrcholov obrazca.
Príklad: brómpentafluorid (BrF5)
Rovinná štvorcová geometria
AX4E2: Atómy nadobúdajú usporiadanie štvorcového tvaru, v ktorom centrálny atóm zaberá stred postavy a ligandy každý z jej vrcholov.
Príklad: Xenon tetrafluoridový ión (XeF4)

Ak si chcete prečítať viac podobných článkov Molekulárna geometria: definícia a príklady, odporúčame vám vstúpiť do našej kategórie Atóm.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Základná chémia. Madrid: Uned