10 typov chemických väzieb (vysvetlené na príkladoch)
Chemické väzby sú sily, ktoré držia atómy pohromade za vzniku molekúl. Medzi atómami existujú tri typy väzieb:
- Kovová väzba.
- Iónová väzba.
- Kovalentná väzba: nepolárna, polárna, jednoduchá, dvojitá, trojitá, datívna.
Vďaka týmto väzbám sa tvoria všetky zlúčeniny, ktoré existujú v prírode. Existujú aj sily, ktoré držia molekuly pohromade, známe ako intermolekulárne väzby, ako napríklad:
- Vodíkové väzby alebo väzby.
- Dipól-dipólové sily.
Ďalej vysvetľujeme každý z týchto odkazov.
| Druhy chemickej väzby | Charakteristické | Príklady | |
|---|---|---|---|
| Kov | Kovové ióny plávajú v mori pohybujúcich sa elektrónov. | Kovové prvky: sodík, bárium, striebro, železo, meď. | |
| Iónsky | Prenos elektrónov z jedného atómu na druhý. | Na chlorid sodný+Cl- | |
| Kovalentný | Nepolárne | Zdieľajte elektróny rovnakým dielom medzi dvoma atómami. | Molekulárny vodík H-H alebo H2 |
| Polárny | Zdieľajte elektróny nerovnomerne medzi dvoma atómami. | Molekula vody H2ALEBO | |
| Jednoduché | Zdieľajte pár elektrónov. | Molekula chlóru Cl2 Cl-Cl | |
| Dvojitý | Zdieľajte dva páry elektrónov. | Molekula kyslíka O2 O = O | |
| Triple | Zdieľajte tri páry elektrónov. | Molekula dusíka N≣N alebo N2 | |
| Datív | Iba jeden z atómov zdieľa elektróny. | Väzba medzi dusíkom a bórom v zlúčenine amónno-boritý trifluorid. | |
| Medzimolekulové sily | Vodíkový mostík | Vodíky v jednej molekule sú priťahované k elektronegatívnym atómom inej molekuly. | Vodíkové väzby medzi vodíkom v jednej molekule vody a kyslíkom v inej molekule vody. |
| Dipól-dipól | Molekuly s dvoma elektrickými pólmi priťahujú opačné póly iných molekúl. | Interakcie medzi molekulami methanalu H.2C = O |
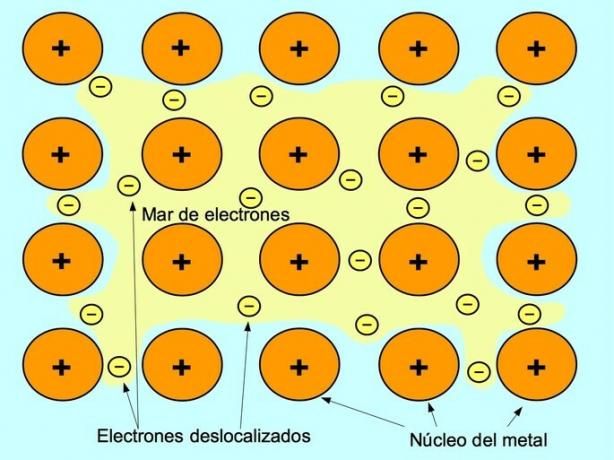
Kovová väzba
Kovová väzba je sila príťažlivosti medzi kladnými iónmi kovových prvkov a zápornými elektrónmi, ktoré sa voľne pohybujú medzi iónmi. Atómy kovov sú pevne zabalené, čo umožňuje elektrónom pohybovať sa v mriežke atómov.
V kovoch sa valenčné elektróny uvoľňujú z pôvodného atómu a tvoria „more“ elektrónov, ktoré plávajú okolo celej kovovej štruktúry. To spôsobí, že sa atómy kovov transformujú na kladne nabité kovové ióny, ktoré sa zhlukujú.
Kovová väzba sa vytvára medzi kovovými prvkami, ako sú sodík Na, bárium Ba, vápnik Ca, horčík Mg, zlato Au, striebro Ag a hliník Al.
Iónová väzba
Iónová väzba je sila, ktorá spája kovový prvok, ako je sodík alebo horčík, s nekovovým prvkom, ako je chlór alebo síra. Kov stráca elektróny a transformuje sa na pozitívny ión kovu tzv katión. Tieto elektróny prechádzajú do nekovového prvku a ten sa transformuje na záporne nabitý ión tzv anión.
Katióny a anióny sa kombinujú a vytvárajú trojrozmernú sieť, ktorá je udržiavaná silami elektrostatickej príťažlivosti medzi iónmi s rôznymi nábojmi. Tieto sily tvoria iónové zlúčeniny.
Zemská kôra je tvorená hlavne iónovými zlúčeninami. Väčšina hornín, minerálov a drahokamov sú iónové zlúčeniny. Napríklad:
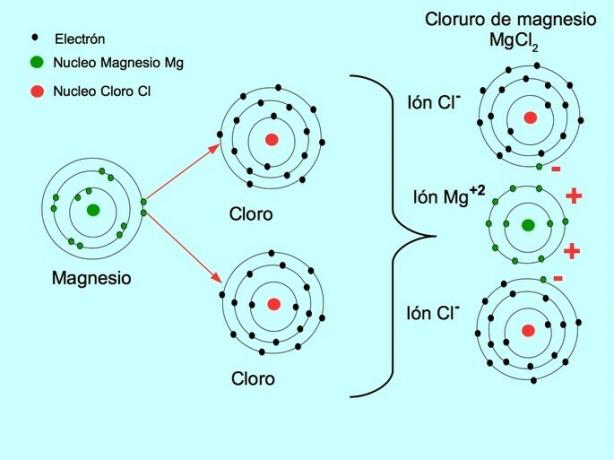
- Chlorid sodný NaCl: kovovým prvkom je sodík, ktorý prenáša elektrón na chlór, ktorý je nekovovým prvkom.
- Chlorid horečnatý MgCl2: Horčík Mg daruje dva elektróny dvom atómom chlóru, ako je znázornené na obrázku nižšie:
Pozri tiež Rozdiel medzi katiónmi a aniónmi.
Kovalentná väzba
Kovalentná väzba sa vytvorí, keď dva nekovové atómy zdieľajú elektróny. Táto väzba môže mať niekoľko typov v závislosti od afinity k elektrónom atómov a od množstva zdieľaných elektrónov.
Nepolárna kovalentná väzba
Nepolárna kovalentná väzba je väzba, ktorá sa tvorí medzi dvoma atómami, kde sú elektróny zdieľané rovnako. Táto väzba sa normálne vyskytuje v symetrických molekulách, to znamená v molekulách zložených z dvoch rovnakých atómov, ako je napríklad molekula vodíka H2 a molekula kyslíka O2.

Polárna kovalentná väzba
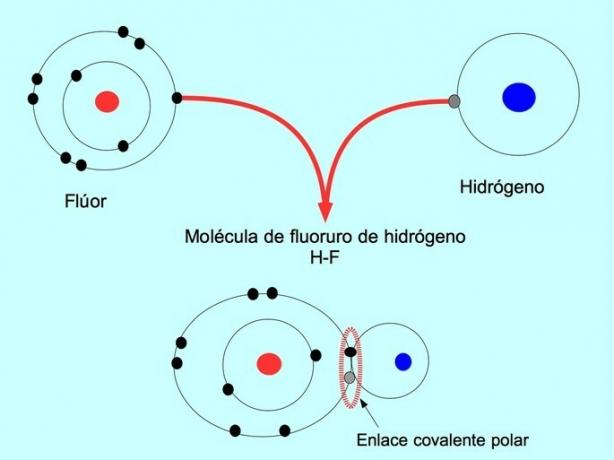
Polárna kovalentná väzba sa vytvorí, keď dva atómy zdieľajú elektróny, ale jeden z nich má väčšiu príťažlivosť pre elektróny. Vďaka tomu má molekula negatívnejší „pól“ s väčším počtom elektrónov a opačný pól je pozitívnejší.
Molekuly s touto distribúciou alebo nerovnováhou elektrónov sú známe ako polárne. Napríklad vo fluorovodíku HF existuje kovalentná väzba medzi vodíkom a fluórom, ale fluór má vyššiu elektronegativitu, takže silnejšie priťahuje elektróny zdieľané.
Jednoduchá kovalentná väzba
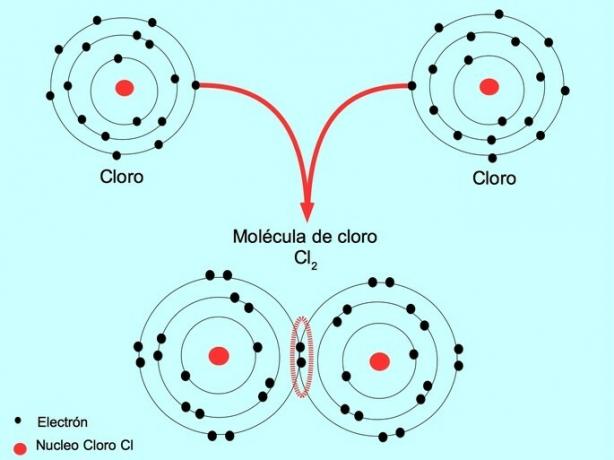
Keď dva atómy zdieľajú dva elektróny, po jednom od každého, vytvorená kovalentná väzba sa nazýva jednoduchá kovalentná väzba.
Napríklad chlór je atóm, ktorý má vo svojom vonkajšom obale sedem valenčných elektrónov, ktoré môžu byť naplnené ôsmimi elektrónmi. Chlór sa môže kombinovať s iným chlórom za vzniku molekuly chlóru Cl2 ktorý je oveľa stabilnejší ako samotné chlóry.
Dvojitá kovalentná väzba
Dvojitá kovalentná väzba je väzba, kde sú štyri elektróny (dva páry) elektrónov rozdelené medzi dva atómy. Napríklad kyslík má vo svojej poslednej škrupine 6 elektrónov. Keď sa spoja dva kyslíky, rozdelia sa medzi ne štyri elektróny, čo spôsobí, že každý z nich bude mať v poslednej škrupine 8 elektrónov.
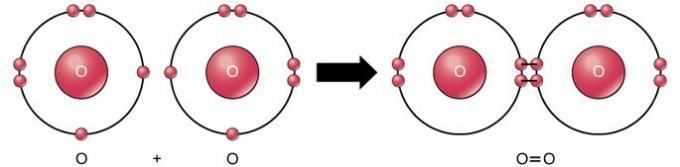
Trojitá kovalentná väzba
Trojitá kovalentná väzba sa vytvorí, keď je medzi dvoma atómami rozdelených 6 elektrónov (alebo tri páry). Napríklad v molekule kyanovodíka HCN sa vytvorí trojitá väzba medzi uhlíkom a dusíkom, ako je znázornené na obrázku nižšie:
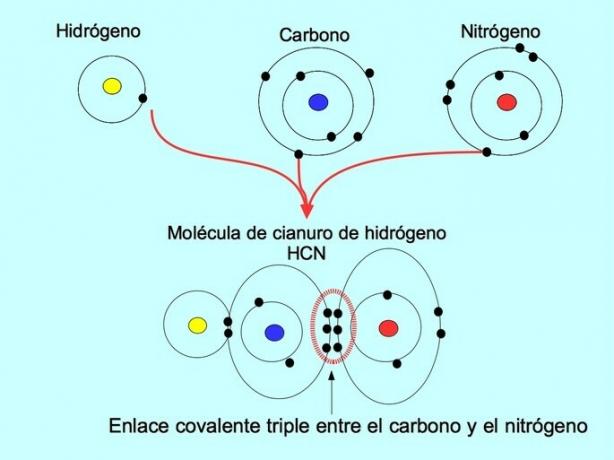
Súradnicová alebo datívna kovalentná väzba
Kovalentná súradnica alebo datívna väzba je väzba, ktorá sa vytvorí, keď iba jeden z atómov vo väzbe prispieva dvojicou elektrónov. Napríklad keď reaguje amoniak NH3 s fluoridom boritým BF3„Dusíkaté väzby s dvoma elektrónmi priamo na bór, ktorý nemá k dispozícii žiadne elektróny na zdieľanie. Týmto spôsobom zostáva dusíku aj bóru 8 elektrónov vo svojej valenčnej škrupine.
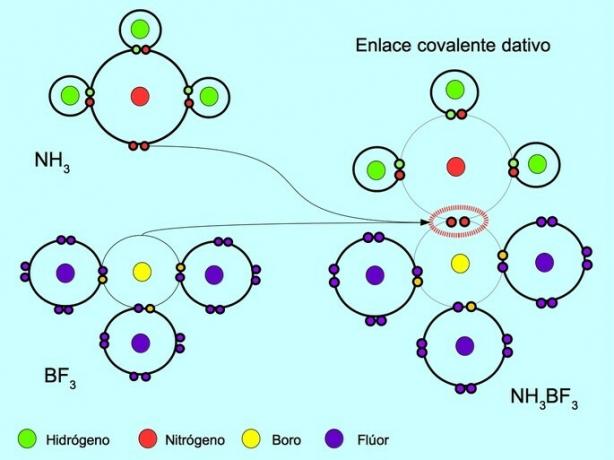
Pozri tiež Organické a anorganické zlúčeniny.
Medzimolekulové väzby
Molekuly sa spájajú prostredníctvom síl, ktoré umožňujú vytvárať látky v kvapalnom alebo tuhom stave.
Dipól-dipólové väzby alebo sily
Slabé medzimolekulové väzby môžu byť vytvorené medzi polárnymi molekulami, keď sú negatívne póly priťahované k pozitívnym pólom a naopak. Napríklad metanal H2C = O je polárna molekula s čiastočným negatívnym nábojom na kyslíku a čiastočným pozitívnym nábojom na vodíkoch. Pozitívna stránka jednej metanalovej molekuly priťahuje negatívnu stránku inej metanalovej molekuly.
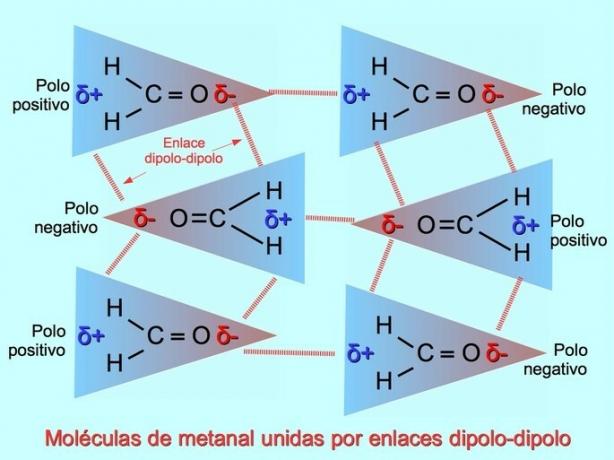
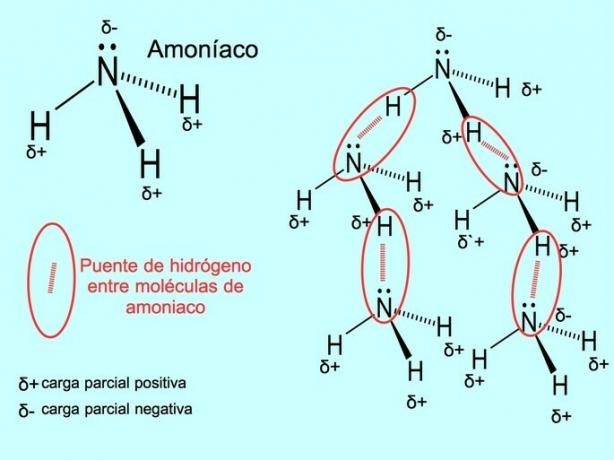
Vodíkové väzby alebo väzby
Vodíková väzba alebo vodíková väzba je väzba, ktorá je vytvorená medzi molekulami. Nastáva, keď je vodík v molekule kovalentne viazaný na kyslík, dusík alebo fluór. Kyslík, dusík a fluór sú atómy s vyššou elektronegativitou, preto priťahujú elektróny silnejšie, keď ich zdieľajú s iným menej elektronegatívnym atómom.
Medzi molekulami vody H sú vodíkové väzby2O a amoniak NH3 ako ukazuje obrázok:
Mohlo by vás zaujímať:
- Atómy a molekuly.
- Príklady organických a anorganických zlúčenín.
- Kovy a nekovy
Referencie
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemistry. Deviate vydanie. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5. vydanie. Pearson Austrália. Melbourne.


