Moellerov diagram: čo to je, ako sa používa v chémii a príklady
Chémia môže byť obzvlášť komplikovaná, takže každý nástroj, ktorý uľahčuje učenie tým, ktorí sú s ňou oboznámení, je vítaný.
Jednou z najpopulárnejších metód oboznámenia sa s Madelungovým pravidlom a elektrónovou konfiguráciou atómov je Moellerov diagram, grafické mnemotechnické pravidlo, vďaka ktorému je veľmi ľahké zistiť, v ktorých orbitáloch je elektróny.
Ďalšie zistíme, z čoho pozostáva Moellerov diagram, ako súvisí s Madelungovým pravidlom, ako sa aplikuje pomocou niekoľkých vyriešených príkladov a ktoré chemické prvky sa tejto stratégii neriadia.
- Súvisiaci článok: "5 typov chemických väzieb: takto sa skladá hmota"
Čo je Moellerov diagram?
Moellerov diagram, známy aj ako dažďová metóda alebo pravidlo uhlopriečok, je grafická a mnemotechnická metóda na učenie sa Madelungovho pravidla, technika na poznanie a zápis elektronickej konfigurácie chemických prvkov.
Tento diagram je charakterizovaný kreslením uhlopriečok cez stĺpce orbitálov, zhora nadol sprava doľava. Prostredníctvom Moellerovho diagramu je definovaný poriadok v zapĺňaní orbitálov, ktorý bude definovaný tromi kvantovými číslami: n, l a ml.
Moellerov diagram funguje nasledovne:

Každý stĺpec zodpovedá inému orbitálu, cez ktorý cirkulujú elektróny atómu, subatomárne častice, ktoré majú záporný náboj. Príslušné orbitály sú: s, p, d a f, každý so špecifickým priestorom na umiestnenie elektrónov, a teda s rôznymi energetickými hladinami.
Ak nakreslíme uhlopriečky alebo šípky vo vyššie uvedenom zmysle, máme, že prvý orbitál je 1 s. Druhá šípka začína orbitálom 2s. Tretia šípka pretína 2p a 3s. Štvrtá uhlopriečka je 3p a 4s. Piata uhlopriečka je 3d, 4p a 5s a tak ďalej. Moellerov diagram je úvodná technika pre tých, ktorí začínajú študovať elektronické konfigurácie prvkov periodickej tabuľky v chémii.
- Mohlo by vás zaujímať: "6 hlavných odvetví prírodných vied"
Madelungovo pravidlo
Od Moellerovho diagramu je grafickým znázornením Madelungovho pravidla (v niektorých krajinách známe aj ako Klechkovského pravidlo) musíme najskôr vedieť, o čo ide. Podľa tohto pravidla sa vyplnenie orbitálov atómu musí riadiť nasledujúcimi dvoma pravidlami:
Madelungovo prvé pravidlo
Najprv sa vyplnia orbitály s najnižšími hodnotami n + l, pričom n je hlavné kvantové číslo a l je orbitálny moment hybnosti..
Napríklad 3d orbital zodpovedá n = 3 a l = 2. Preto n + l = 3 + 2 = 5. Namiesto toho orbitál 4s zodpovedá n = 4 a l = 0, teda n + l = 4 + 0 = 4. Z toho vyplýva, že elektróny vyplnia najskôr orbitál 4s pred orbitálom 3d, pretože 4s = 4, zatiaľ čo 3d = 5.
- Súvisiaci článok: "11 typov chemických reakcií"
Madelungovo druhé pravidlo
Ak majú dva orbitály rovnakú hodnotu n + l, elektróny najskôr obsadia ten s nižšou hodnotou n.
Napríklad 3d orbitál má hodnotu n + l = 5, identickú s hodnotou 4p orbitálu (4 + 1 = 5), ale keďže 3d orbitál má najnižšiu hodnotu pre n, vyplní sa ako prvý. 4p orbitálne.
Zo všetkých týchto pozorovaní a pravidiel možno vyvodiť nasledovné poradie pri vypĺňaní atómových orbitálov: 1s 2s 2p 3s 3p 4s 3d 4p. Toto poradie je síce pevné, no zapamätať si ho naspamäť je komplikované, a preto existuje Moellerov diagram, ktorý graficky znázorňuje jeho poradie.
- Mohlo by vás zaujímať: "9 postulátov Daltonovej atómovej teórie"
Kroky, ktoré treba dodržať pri použití Moellerovho diagramu
Ako sme už uviedli v predchádzajúcej časti, Madelungovo pravidlo používa vzorec n + l na určenie čoho orbitály sú predtým vyplnené a z toho určujú, aká je elektronická konfigurácia prvku určený. Moellerov diagram to však už znázorňuje graficky a jednoducho, takže stačí postupovať podľa stĺpce toho istého diagramu a nakreslite uhlopriečky, aby ste zistili, v akom poradí sú orbitály každého z nich element.
Aby sme objavili elektrónovú konfiguráciu atómu a v ktorých orbitáloch sa nachádzajú jeho elektróny, musíme najprv poznať jeho atómové číslo Z. Číslo Z zodpovedá počtu elektrónov v atóme, pokiaľ je tento atóm neutrálny, alebo čo je to isté, že to nie je ión, ani kladný (katión) ani záporný (anión).
Keď teda poznáme Z ako neutrálny atóm, už vieme, koľko elektrónov má zvyčajne neutrálny atóm tohto prvku. S ohľadom na to začneme kresliť uhlopriečky do Moellerovho diagramu. Musíme vziať do úvahy, že každý typ orbitálu má inú kapacitu na uloženie elektrónov, ktoré sú:
- s = 2 elektróny
- p = 6 elektrónov
- d = 10 elektrónov
- f = 14 elektrónov
Zastaví sa na orbitále, kde bol obsadený posledný elektrón daný Z.
Príklady Moellerovho diagramu
Aby sme lepšie pochopili, ako funguje Moellerov diagram, nižšie uvidíme niekoľko praktických príkladov nastavenia elektrónovej konfigurácie rôznych prvkov.
Berýlium
Aby sme stanovili elektronickú konfiguráciu neutrálneho atómu berýlia (Be), musíme ho najprv vyhľadať v periodickej tabuľke, alkalická zemina, ktorá sa nachádza v druhom stĺpci a druhom riadku tabuľky. Jeho atómové číslo je 4, teda Z = 4 a má tiež 4 elektróny.
Berúc do úvahy toto všetko, použijeme Moellerov diagram, aby sme videli, ako sú umiestnené 4 elektróny tohto prvku. Začneme tým, že urobíme uhlopriečky v už spomínanom zmysle, zhora nadol a sprava doľava.
Keď vypĺňame orbitály, Odporúča sa uviesť počet elektrónov nájdených v každom z nich ako horný index. Keďže 1s je prvý orbitál a zaberá dva elektróny, napíšeme to:

Keďže máme ešte voľné elektróny, pokračujeme v dopĺňaní orbitálov. Ďalej je orbitál 2s a rovnako ako pri 1s zaberá 2 elektróny, teda 2s2. Keďže už máme všetky elektróny dobre umiestnené v orbitáloch neutrálneho atómu Be, môžeme povedať, že elektrónová konfigurácia tohto prvku je:

Ubezpečíme sa, že sme urobili dobre, pridaním horných indexov: 2 + 2 = 4
- Mohlo by vás zaujímať: "Molekulárna kinetická teória: 3 stavy hmoty"
Zápas
Prvok fosfor (P) je nekov, ktorý sa nachádza v treťom riadku a stĺpci 16 periodickej tabuľky., so Z = 15, teda má celkovo 15 elektrónov, ktoré musia obsadiť orbitály.
Keď sme videli predchádzajúci príklad, môžeme sa posunúť o kúsok dopredu a nájsť 4 jeho elektróny v rovnakých orbitáloch, aké má berýlium pre svoje 4 elektróny, chýba 9 elektrónov plus.

Po 2s orbitále sa ďalšia diagonála dostane do 2p orbitálu a končí na 3s orbitále. Orbitál 2p môže zaberať 6 elektrónov a v prípade 3s iba 2. Mali by sme teda:
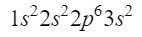
Momentálne máme dobre umiestnených 12 elektrónov, ale stále máme 3 ďalšie. Urobíme ďalšiu uhlopriečku a tentoraz vstúpime cez orbitál 3p podľa Moellerovho diagramu, orbitál, ktorý má priestor pre 6 elektrónov, ale keďže nám ostali len 3 elektróny, tento orbitál nebude úplne obsadený, pričom 3 uvedieme ako horný index. Na ukončenie fosforu je teda jeho elektronická konfigurácia nasledovná:

Ubezpečíme sa, že sme urobili dobre, pridaním horných indexov: 2 + 2 + 6 + 2 + 3 = 15
Zirkónium
Prvok zirkónium (Zr) je prechodný kov nachádzajúci sa v stĺpci 4 a riadku 5 a má Z = 40. Skrátením cesty s využitím predchádzajúceho príkladu môžeme nájsť prvých 18 elektrónov.
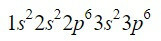
Po orbitále 3p sú ďalšie, ktoré sa majú vyplniť, pričom nás vedie Moellerov diagram, orbitály 4s, 3d, 4p a 5s, s kapacitou pre 2, 10, 6 a 2 elektróny.

Dokončenie prvých deviatich orbitálov v diagrame pridá celkom 20 elektrónov, zostávajúce 2 zostávajúce elektróny, ktoré sú umiestnené v ďalšom orbitále, 4d. Elektrónová konfigurácia neutrálneho prvku zirkónia je teda:
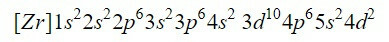
Ubezpečujeme sa, že sme urobili dobre, pridaním horných indexov: 2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 2 = 40
Kyslík
Tu vidíme trochu komplikovanejší príklad, ktorým je kyslík (O). Tento plyn sa nachádza v stĺpci 16 a riadku 2 periodickej tabuľky, je to nekov a má atómové číslo 8.
Zatiaľ, pri pohľade na ostatné príklady, by sme si mysleli, že jeho Z = 8, ale nie je to také jednoduché, pretože tento plyn je špeciálnej povahy, takmer vždy je vo forme iónu s nábojom -2.
To znamená, že hoci neutrálny atóm kyslíka má 8 elektrónov, ako naznačuje jeho atómové číslo, má Je pravda, že v prírode má viac, v jej prípade 10 (8 elektrónov + 2 elektróny alebo ak chcete -8 náboja elektrický -2).
Takže v tomto prípade počet elektrónov, ktoré musíme v orbitáloch lokalizovať, nie je 8, ale 10 elektrónov, ako keby sme lokalizovali elektróny chemického prvku neón, ktorý má Z = 10.
Keď to pochopíme, musíme urobiť len to isté, čo sme robili v predchádzajúcich prípadoch, len s prihliadnutím na to, že pracujeme s iónom (aniónom):
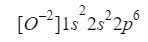
Či sme urobili dobre, sa presvedčíme pridaním horných indexov: 2 + 2 + 6 = 10
Vápnik
Niečo podobné ako kyslík sa deje s vápnikom (Ca), len v tomto prípade hovoríme o katióne, teda o ióne s kladným nábojom.
Tento prvok sa nachádza v stĺpci 2 riadok 4 periodickej tabuľky s atómovým číslom 20, avšak v Príroda je zvyčajne prezentovaná vo forme iónu s kladným nábojom +2, čo znamená, že jeho elektronický náboj je 18 (- 20 + 2 = 18; 20 elektrónov – 2 elektróny = 18 elektrónov).
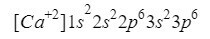
Ubezpečíme sa, že sme urobili dobre, pridaním horných indexov: 2 + 2 + 6 + 2 + 6 = 18
Výnimky z Moellerovho diagramu a Madelungovho pravidla
Hoci je Moellerov diagram veľmi užitočný na pochopenie Madelungovho pravidla a na to, ako sa nachádzajú elektróny rôznych chemických prvkov, pravdou je, že nie je neomylný. Existujú určité látky, ktorých zloženie nie je v súlade s tým, čo sme vysvetlili.
Ich elektrónové konfigurácie sa experimentálne líšia od konfigurácií predpovedaných Madelungovým pravidlom z kvantových dôvodov.. Medzi tieto prvky, ktoré nespĺňajú normy, máme: chróm (Cr, Z = 24), meď (Cu, Z = 29), striebro (Ag, Z = 47), ródium (Rh, Z = 45), cér ( Ce, Z = 58), niób (Nb; Z = 41), medzi inými.
Pri plnení orbitálov d a f sú veľmi časté výnimky. Napríklad v prípade chrómu, ktorý by mal mať valenčnú konfiguráciu končiacu na 4s ^ 2 3d ^ 4 podľa Moellerovho diagramu a Madelungovho pravidla, má v skutočnosti valenčnú konfiguráciu 4s ^ 1 3d ^ 5. Ďalším zvláštnym príkladom je striebro, ktoré namiesto toho, aby malo 5s ^ 2 4d ^ 9 ako posledné, má 5 s ^ 1 4d ^ 10.
