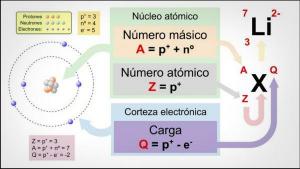
KLASSIFICERING av METALLER från det periodiska systemet

De metaller är de mer rikliga element på periodiska systemet. De kännetecknas av att vara bra ledare för värme och elektricitet, vara fasta vid rumstemperatur (med med undantag av kvicksilver som är flytande) och har förmågan att reflektera ljus, så de presenterar en glans karakteristisk.
Men denna stora uppsättning element presenteras ordnade inom det periodiska systemet i olika grupper eller familjer som återspeglar deras likheter och skillnader. I den här lektionen från en LÄRARE kommer vi att se vad klassificering av metaller och vilka egenskaper och egenskaper hos de olika grupperna som definieras i denna klassificering.
Som vi redan har nämnt är metaller de flesta elementen i periodiska systemet. De distribueras i två fantastiska killar som i varje fall inkluderar olika undertyper som är grupperade i familjer av de olika blocken i det periodiska systemet.
Nedan presenterar vi en kort beskrivning av denna klassificering, som vi kommer att utveckla mer detaljerat i följande avsnitt.
- 1. Representativa metaller: s block av det periodiska systemet.
- 1.1. Familj av alkaliska metaller
- 1.2. Familj av alkaliska jordartsmetaller
- 2. Övergångsmetaller: block d i det periodiska systemet.
- 3. Interna övergångsmetaller: blockera f i det periodiska systemet.
- 3.1. Lanthanides: delar av den sjätte perioden av tabellen.
- 3.2. Actinides: delar av tabellens 7 period.
- 4. Metaller efter övergången: p-block i det periodiska systemet.
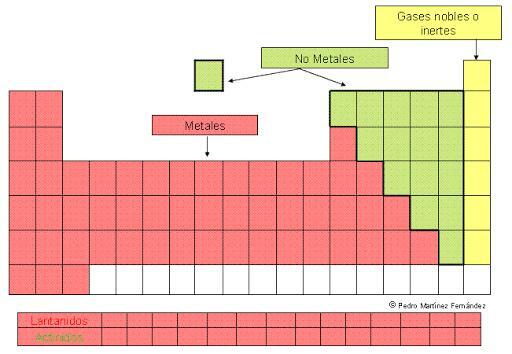
Bild: Educamix
De representativa elementen eller huvudelementen är de element som är mer riklig i naturen. Bland de metalliska elementen är representativa element metallerna i blockera s, det vill säga de alkaliska elementen (familj 1 i det periodiska systemet) och jordalkaliska elementen (familj 2 i det periodiska systemet).
I dessa två grupper hittar vi mycket reaktiva element, med en stark tendens att oxidera (förlora sina elektroner från valensskalet) och därför är de kraftfulla reducerare av andra element. I naturen finns de i form av joniska salter som är mycket lösliga i vatten, oxider eller hydroxider (starka baser).
Alkalimetaller (grupp 1 i det periodiska systemet)
- Alkalimetaller representerar 5% av jordskorpan. Natrium (Na) och kalium (K) de är de vanligaste.
- Dom är glänsande element silvrig i utseende, låg densitet, mjuka metaller och mycket reaktiva. På grund av sin höga reaktivitet finns de inte i sitt rena tillstånd i naturen. Kok- eller avdunstningspunkterna för alkalimetaller är relativt låga och de är bra ledare för värme och elektricitet.
- Ur synpunkten för deras elektroniska konfiguration är de element som presenterar a enda elektron ockuperar sin valens skal. De har en kombinerande effekt på 1 (valens) och oxidationsnummer +1. De visar en stor tendens att förlora elektronen från det yttersta skalet för att bilda katjoner.
- Som bioelement utvecklar alkalimetaller a viktig roll i levande organismer, speciellt natrium och kalium, som spelar en grundläggande roll vid nervöverföring och, i fallet med kalium, vid reglering av enzymaktivitet.
- Dessa metaller har flera användningsområden inom industrin. Till exempel används litium (Li) för att producera höghållfasta aluminiumlegeringar, i keramisk produktion eller som batterikomponenter. Det har också medicinsk användning eftersom det utgör en del av nervsystemet och dess brist orsakar psykiatriska sjukdomar.
Notera: Grupp 1 i det periodiska systemet inkluderar också väte, som inte är en metall.
Jordalkalimetaller (grupp 2 i det periodiska systemet):
- Jordalkalimetallerna representerar 4% av jordskorpans sammansättning. De är särskilt rikliga kalcium (Ca) och magnesium (Mg).
- Liksom alkalimetallerna, dessa metaller de är väldigt reaktiva därför finns de inte i fri form i naturen.
- Även om de har liknande fysikalisk-kemiska egenskaper som alkalimetaller tenderar de att vara hårdare och mindre reaktiva än alkalimetaller. De har låga densiteter och hårdheter och smältpunkter högre än alkalimetallernas.
- Ur elektronkonfigurationssynpunkt kännetecknas de av presentera omloppet för det fyllda valensskalet (det vill säga upptagen av ett par elektroner). Därför har de en kombinerande effekt på 2 (valens) och ett oxidationsnummer på +2. De reagerar lätt med halogener (grupp 17 i det periodiska systemet) för att bilda joniska salter.
- Din roll som beståndsdelar av levande organismer det är särskilt viktigt när det gäller kalcium (Ca) och magnesium (Mg). Magnesium- och kalciumjoner är de vanligaste jonerna i havsvatten tillsammans med kloridjonen (Cl-).
- 99% av kalciumet i vår kropp finns i skelettet men i jonform har en grundläggande roll i nervöverföring, neuromuskulär funktion och reglering enzymatisk.
- Magnesium, i sin jonform, utför viktiga biologiska funktioner i levande organismer, inklusive den mest framträdande, dess grundläggande roll i fotosyntesen av växter som en del av klorofyll.
- De industriella användningarna av jordalkalimetaller är olika. Det mest relevanta är användningen av kalcium som en komponent i cement, användningen av magnesium för att utveckla bränder konstgjord, som en beläggning av järnstrukturer för att förhindra oxidation av dem eller som en komponent i legeringar och stål ljus.
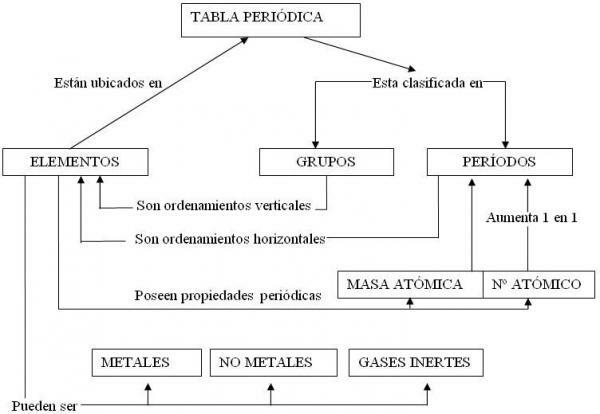
Bild: Google Sites
Inom klassificeringen av metaller måste vi prata om övergångsmetaller eller metaller av block d, är den vanligaste metallen och är grupperade i a totalt tio grupper eller familjer i det periodiska systemet.
- De flesta övergångsmetaller har egenskaper som liknar representativa metaller: de är bra ledare för värme och elektricitet och reflekterar ljus.
- De visar stor variation i termer av hårdhet och kok- och smältpunkter, men i allmänhet är de det hårdare och har högre smält- och kokpunkter än alkalimetaller och alkaliska jordarter.
- Från kemisk synvinkel de kännetecknas av att de har flera koordinationstal (valenser) eller oxidationstillstånd, de är vanligtvis bra katalysatorer (förmåga att öka eller minska hastigheten på kemiska reaktioner) och bilda föreningar med färg och ha förmågan att bilda koordinationskomplex (kemiska föreningar med en metalljon i centrum, fästa vid en serie ligander anordnade vid deras runt omkring). Av denna anledning bildar övergångsmetaller katjoner av olika laddningar.
- Densitet är mycket varierande i detta elementblock, från strontium med låg densitet till osmium (Os), vilket är det element som har den högsta densiteten i det periodiska systemet.
- Om vi tittar på den elektroniska konfigurationen av övergångsmetaller kännetecknas de av att presentera delvis fyllda orbitaler. Fyllningen av orbitalerna i detta block i det periodiska systemet presenterar en serie oegentligheter, som återspeglas i de multipla oxidationsnumren som metallerna förvärvar i detta block i tabellen periodisk.
Järn (Fe) och titan (Ti): rikligare övergångsmetaller
- Järn är det vanligaste och representerar cirka 5% av vikten av jordskorpan. Det är sällsynt att hitta det i sin elementära form i naturen, där det normalt finns bildar oxider och karbonater.
- Rent järn har få användningsområden, men dess legeringar med andra ämnen har flera användningsområden. Användbara former av järnlegeringar är smidesjärn (det är en järnlegering som kännetecknas av dess låga kolinnehåll och höga järnhalt. Den har egenskapen att den kan formas glödgande och hårdnar vid snabb kylning), gjutjärn (som också kallas namnet på grå gjutjärn eller gjutjärn, det är en legering av järn, kisel och kol som innehåller små mängder mangan, fosfor och svavel; där kol är i form av grafit) och stål (en renad legering av järn och kol).
- Andra övergångsmetaller som ofta används inom industrin är koppar och silver. Dessutom används många övergångsmetaller inom industrin som katalysatorer för kemiska reaktioner.
- På biologisk nivå har järn i sin jonform en grundläggande roll i syretransport, eftersom det är en del av det aktiva centrumet för hemoglobin och myoglobin.
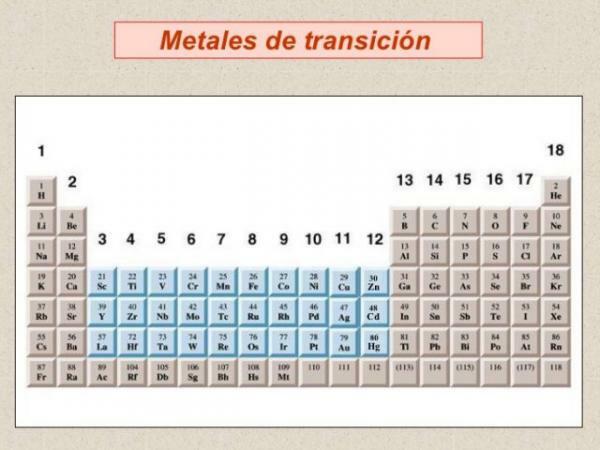
Bild: 100cia-webbplats
De inre övergångsmetallerna eller metallerna i blockera fDe kallas också sällsynta jordarter. De är grupperade i två familjer av element: lantanider och den aktinider. Det är de metallelement där elektroner finns som upptar f-orbitalerna. Elementen i gruppen av lantanider har delvis ockuperat f orbitalerna i nivå 4 och aktiniderna i nivå 5.
Lantanider eller lantanoider
- De är de 15 elementen i intern övergång som är en del av period 6 av elementens periodiska system.
- Denna grupp av element har gemensamma karakteristiska egenskaper. Är om mjuka och silverglansande metaller, Dess ledningsförmåga för värme och elektricitet är relativt låg jämfört med andra metaller. De är metaller med lägre densitet än övergångsmetaller.
- I naturen finns de i låga proportioner och utgör en del av många mineraler. Lantanider har hög kapacitet för magnetisering eller magnetisering och kännetecknas också av deras katjoners luminiscens.
- Lanthanides har flera användningsområden inom industrin vid tillverkning av starka permanentmagneter, uppladdningsbara batterier och tillverkning av superledande material. De har flera applikationer inom optik (tillverkning av lysrör och lampor, flytande kristallskärmar och lasrar). De används också som katalysatorer för kemiska reaktioner eller som pigment.
Aktinider eller aktinoider
- De är de 15 elementen som utgör den period 7 i det periodiska systemet.
- Många av dem har syntetiserats artificiellt, men de finns också i naturen i mycket små proportioner.
- De visar ett beteende som liknar övergångsmetallerna (block d) och skiljer sig från lantanidernas. Som i fallet med många metaller har de en karakteristisk silverglans.
- Som grupp ligger deras betydelse i det faktum att de alla är radioaktiva element. Det vill säga dessa är element vars kärnor är instabila sönderfaller, frigör energi (kärnenergi) och ger upphov till andra kemiska element med en mer stabil kärna. Alla isotoper av elementen i denna grupp är radioaktiva och har en kort halveringstid. De vanligaste aktiniderna i naturen är uran (U) och thorium (Th).
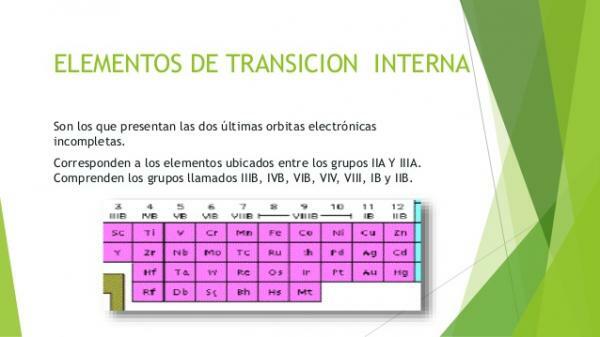
Bild: Bildspel