AZOT DEĞERLERİ NELERDİR?

Azot hayatımızda çok önemli bir kimyasal elementtir., Hem iyi hem de daha kötüsü için. Atmosferdeki ana gazdır, toprakta bulunur ve çoğu canlı için çok önemli bir makromoleküldür. Aynı zamanda amonyak, itici gazlar veya patlayıcılar gibi büyük endüstriyel öneme sahip bileşiklerin bir parçasıdır.
Olan, değerlik ve oksidasyon durumunun bileşiğe bağlı olarak farklı olmasıdır. Bu derste bir ÖĞRETMENden bahsedeceğiz azotun değerleri nelerdir. Bu kimyasal elementi öğrenmekle ilgileniyorsanız, bu makaleyi beğeneceksiniz!
dizin
- Azot nedir ve özellikleri
- Azotun değerleri nelerdir?
- Azotlu bileşiklerin isimlendirilmesi
- Önemli Azot Bileşikleri
- Azotun Sağlık Etkileri
- Azotun çevresel etkileri
Azot nedir ve özellikleri.
Azot, sembolü N olan kimyasal bir elementtir. atom numarası 7, atom ağırlığı 14.0067 olan ve normal şartlar altında gaz halinde bulunur. Moleküler nitrojen, kuru havadaki hacmin %78'ini temsil eder ve bu nedenle atmosferde bulunan ana gazdır.
Atmosferdeki bu yüksek nitrojen konsantrasyonu, atmosferdeki elektriksel etkiden, atmosferik nitrojenin fiksasyonundan kaynaklanır. bakteriyel etki, endüstrilerde kimyasal etki ve organik maddenin bozunması ya da yanma. Birleşik hal oluşturan bileşiklerinde, azot farklı hallerde bulunur.
Canlılar için büyük önem taşıyan bir unsurdur, çünkü Tüm proteinlerin bir parçasıdır hem bitkisel hem de hayvansal ve diğer birçok organik bileşik. Nitrojen, nitrojen ve diğerleri gibi diğer atomlarla güçlü bağlar oluşturur. üçlü bağ oluşturmakBu nedenle, azot bileşikleri büyük miktarda enerjiye sahiptir.
Azot oluşur iki izotop:
- N14 (çok çoğunluk)
- Nükleer reaksiyonlar sırasında üretilen N15 ve çeşitli radyoaktif izotoplar.
Kimya endüstrisinde ve tarımda kullanılan bileşiklerde büyük ilgi gören bir elementtir. Ayrıca akkor lamba ampullerinde ve nispeten atıl bir atmosfere ihtiyaç duyulduğunda kullanılır.
Elementel formundaki azot, normal sıcaklıklarda en yaygın maddelerle biraz reaktiftir, yüksek sıcaklıkta ise titanyum, alüminyum, silikon, bor, berilyum, kalsiyum, lityum veya krom gibi birçok madde ile oksijen (O2) ile reaksiyona girer. gibi çok önemli bir endüstriyel bileşik oluşturmak için yüksek sıcaklık ve basınçta nitröz oksit (NO) ve hidrojen ile oksitler oluşturur. amonyak.
Resim kaynağı: Monographs.com
Azotun değerleri nelerdir?
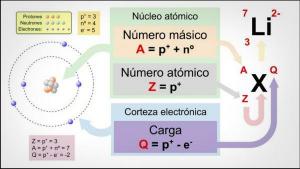
bu bir kimyasal elementin değerleri O mu numara itibaren elektronlar ne eksik veya ne vermeleri gerekir son elektronik seviyenizi doldurmak için.
bu atomlar genellikle sahip olurlar 7 seviye veya katman 1 en içte ve 7 en dışta olmak üzere elektronların bulunduğu yerdir. Sırayla, s, p, d ve f olarak adlandırılan farklı alt düzeyler vardır. Bir atomda elektronlar, enerjilerine göre farklı seviyeleri doldurur, önce düşük enerji seviyelerini doldurur ve daha sonra bir üst seviyeye geçer.
için atomun en dış seviyesi olarak da adlandırılır değerlik kabuğu ve bu kabukta bulunan elektronlara denir. değerlik elektronları. Bu elektronlar, bağların oluşumundan ve olası kimyasal reaksiyonlardan sorumludur. diğer atomlarla, yani bir atomun fiziksel ve kimyasal özelliklerinden sorumlu elektronlardır. öğe.
Azotun farklı şekillerde birleşmesi ona bir değer verecektir (oksidasyon durumu olarak da bilinir). Azot, grubundaki diğer elementlerin yaptığı gibi değerlik kabuğunu genişletemez. Olası değerleri -3, +3 ve +5'tir. Azotun değerlik durumu, parçası olduğu bileşiğe bağlı olarak değişir. Azot ailesinin diğer elementleri de bu oksidasyon durumlarına sahiptir ve fosfor (P), antimon (Sb), bizmut (Bi), moskovyum (Mc) ve arsenik (As)'dir.
Azotlu kimyasal bileşiklerin oluşumu değerlik bağ teorisi ile açıklanabilir., azotun her oksidasyon durumunun elektronik konfigürasyonuna göre. Bunu açıklamak için, değerlik kabuğundaki elektronların sayısı ve bir soy gazın elektronik konfigürasyonuna ulaşmak için kaç tanesinin eksik olduğu dikkate alınır.

Azotlu bileşiklerin isimlendirilmesi.
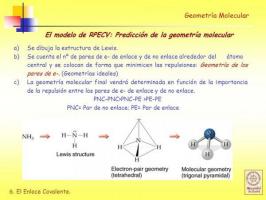
Azot bileşikleri kimyasal olarak karmaşıktır ve geleneksel isimlendirme onları kolayca adlandırmak ve tanımlamak için yeterli değildi, bu yüzden Uluslararası Temel ve Uygulamalı Kimya Birliği'nin (IUPAC) oluşturduğu (ayrıca diğer faktörlerden dolayı) a sistematik isimlendirme Bileşikler kendilerini oluşturan atom sayılarına göre isimlendirilirler.
Bu isimlendirme özellikle nitrojen oksitlerin isimlendirilmesi için uygundur. Bu nedenle nitrik oksit, nitrojen monoksit ve nitroz oksit (NO), dinitrojen monoksit (N2O) olarak adlandırılır.
Bu terminolojiye ek olarak, 1919'da Alman kimyager alfred hisse senedi bileşiklerin isimlendirildiği bir yöntem geliştirdi. oksidasyon durumuna bağlı olarak, Romen rakamları ve parantez içinde gösterilir. Bu şekilde nitrik oksit, nitrojen oksit (II) ve nitroz oksit, nitrojen oksit (I) olarak adlandırılacaktır.
Resim: Youtube
Önemli azot bileşikleri.
Azot, çok sayıda olası oksidasyon durumu nedeniyle farklı elementlere bağlanma ve çok sayıda bileşik oluşturma yeteneğine sahiptir. Moleküler nitrojen durumunda değeri tanım gereği 0'dır.
En yaygın oksidasyon durumlarından biri -3'tür. Bu oksidasyon durumunda nitrojen, amonyak (NH3), amonyum iyonu (NH4) gibi bileşikler oluşturur.-), nitriller (C≡N), iminler (C=N-R) veya aminler (R3N). Azot -2 oksidasyon durumundayken değerlik kabuğunda 7 elektron kalır. Değerlik kabuğundaki tek sayıda elektron, iki nitrojen atomu arasında köprü bağlarının oluşmasını kolaylaştırır. Bu durumda nitrojen, hidrazonları (C=N-N-R2) ve hedrazinleri (R2-N-N-R2) oluşturur. -1 oksidasyon durumunda, değerlik kabuğunda 6 elektron kalır ve hidroksil amin (R2NOH) ve azo bileşikleri (RN=NR) gibi bileşikler oluşur.
Azot pozitif oksidasyon durumlarına ulaştığında, Azot, oksitler, oksiasitler veya oksi tuzları oluşturmak için oksijen atomlarına bağlanır. +1 oksidasyon durumunda, azot değerlik kabuğunda 4 elektronla bırakılır. Bu nedenle, halk arasında güldüren gaz olarak bilinen dinitrojen oksit (N2O) ve nitröz bileşikler (R=NO) gibi örneklere sahibiz. +2 durumunda, metallerin seyreltik nitrik asit ile reaksiyonu sırasında oluşan renksiz bir gaz olan nitrojen oksit veya nitrik oksit (NO) bulunur. Bu bileşik, nitrojen dioksit (NO2) gibi önemli bir atmosferik kirletici oluşturmak için oksijen ile reaksiyona girebilen çok kararsız bir serbest radikale sahiptir.
+3 durumunda, bazik çözeltide (NO2–) nitrit gibi bileşikler oluşur. veya asit çözeltisi içinde nitröz asit (HNO2). Her ikisi de nitrik okside (NO) yol açabilen oksitleyici maddelerdir veya nitrat iyonunu oluşturmak için indirgeyici maddeler olabilir. Diğer bileşikler dinitrojen trioksit (N2O3) ve nitro grubudur (R-NO2). +4 durumunda nitrik dioksit (NO2) veya nitrojen dioksit bulunur. Bu, dinitrojen tetroksit (N2O4) oluşturmak için birçok metalin konsantre nitrik asit ile reaksiyona girmesiyle üretilen kahverengi renkli bir gazdır. +5'te asit çözeltilerinde oksitleyici maddeler olan nitratları veya nitrik asidi bulabiliriz.
En sonunda, Azotun farklı oksidasyon durumlarında olduğu bileşikler vardır.. Bunlar nitrosilazid veya dinitrojen trioksit gibi bileşiklerdir.
Resim: Ortam
Azotun sağlık üzerindeki etkileri.
Moleküler nitrojen, atmosferik gazın ana gaz halindeki bileşenidir. Suda ve toprakta nitrat ve nitrit şeklinde bulabiliriz. Bu bileşiklerin tümü azot döngüsünde birbirleriyle bağlantılıdır.
İnsan eylemi nitrat ve nitrit konsantrasyonlarını değiştirdi karada, esas olarak toprağa nitratlı gübrelerin uygulanması yoluyla. Ayrıca, nitrojen döngüsü yoluyla endüstriler tarafından salınan nitrojen, toprak ve sudaki nitrat ve nitrit konsantrasyonunu artırır. Bu da içme suyunda azot artışına neden olabilir.
bu nitrat ve nitritlerin insan sağlığına etkileri olabilirler:
- Nitratların tiroid bezinin aktivitesi üzerinde olumsuz bir etkisi vardır.
- Nitratlar A vitamini deposunu azaltır
- Hem nitratlar hem de nitritler, kanserin yaygın bir nedeni olan nitrozaminler üretir.
- Nitrit, hemoglobin ile reaksiyona girerek kanın oksijen taşıma kapasitesinde azalmaya neden olur.
- Azot oksit (NO), insan vücudunda gevşemeye neden olan temel bir habercidir. kas, kardiyovasküler sistemdeki faydalar veya hücreler üzerinde sinyal etkisi yapan bağışıklık sistemi. Bu etkiler, kalp krizlerine karşı ilaçlar veya Viagra gibi birçok tıbbi uygulamada halihazırda kullanılmaktadır.
Azotun çevresel etkileri.
Gübrelere nitrat ve nitritlerin eklenmesi çevresel konsantrasyonlarında artışa neden olur., yanı sıra farklı endüstriyel süreçler. Bu bileşiklerin birçoğu atmosfere kaçabilir ve oksijenle reaksiyona girerek, sera etkisinin artmasını destekleyen atmosferik kirleticilere yol açabilir.
Buna karşılık, nitratlar ve nitritler de tatlı su ve deniz ortamında olumsuz etkiler yaratır, bu ekosistemi ve türleri olumsuz etkileyen onu yaşayan. Ayrıca bu azotlu bileşiklerin içme sularındaki konsantrasyonları da hızla artmakta ve insan sağlığı üzerinde olumsuz etkiler yaratmaktadır.
Buna benzer daha fazla makale okumak istiyorsanız azotun değerleri nelerdir, kategorimize girmenizi tavsiye ederiz. Atom.
bibliyografya
- Mayz Figueroa, J. (2004). Biyolojik azot fiksasyonu. UDO Tarım Bilimi Dergisi, 4(1), 1-20.
- Celaya-Michel, H. ve Castellanos-Villegas, A. VE. (2011). Kurak ve yarı kurak bölgelerin topraklarında azot mineralizasyonu. Terra Latinoamericana, 29(3), 343-356.
- Cárdenas-Navarro, R., Sánchez-Yáñez, J. M., Farías-Rodriguez, R. ve Peña-Cabriales, J. J. (2004). Tarımda azot girdileri. Chapingo Dergisi Bahçe Bitkileri Serisi, 10(2), 173-178.